文献学习
Title:Traumatic Brain Injury Causes Chronic Cortical Inflammation and Neuronal Dysfunction Mediated by Microglia
DOI: https://doi.org/10.1523/JNEUROSCI.2469-20.2020
题目:创伤性脑损伤导致由小胶质细胞介导的慢性皮质炎症和神经元功能障碍
创伤性脑损伤(TBI)可能导致显著的神经精神问题和神经退行性病理,这些问题在受伤后多年仍然存在和发展。与此同时,神经炎症过程也在这段时间内演变。因此,研究人员的目标是确定小胶质细胞在创伤后急性(1天)、亚急性(7天)和慢性(30天)时期对神经病理的贡献。在给雄性小鼠进行中线液体冲击伤(FPI)之前,使用CSF1R拮抗剂PLX5622去除了小胶质细胞,并使用神经病理mRNA面板评估了皮层神经病理/炎症。受伤后急性时期(1天)与炎症和神经病理有关的基因表达大幅增加,这些表达的大部分与小胶质细胞无关。然而,在7天和30天时,小胶质细胞的减少逆转了与TBI相关的与炎症、干扰素信号和神经病理有关的基因表达。在亚急性和慢性的终点,大量被抑制的基因归因于神经元。为了理解小胶质细胞、神经元和其他胶质细胞之间的关系,研究人员在7天完成了单细胞RNA测序,这是从急性到慢性发病演变的关键时期。皮层小胶质细胞表现出与TBI相关的独特聚类,与type-1干扰素和与神经退行性/损伤相关的基因增加。在皮层神经元中,与多巴胺信号、长时程增强、钙信号和突触生成有关的基因被抑制。小胶质细胞的减少逆转了神经元的大部分这些改变。此外,7天时皮层树突复杂度减少,30天时神经元连接性减少,30天时出现认知障碍。这些与TBI相关的功能和行为障碍都通过小胶质细胞的减少而得到预防。总的来说,这些研究表明,在TBI后,小胶质细胞促进持续的神经病理和神经元稳态的长期功能障碍。
一、研究背景
创伤性脑损伤(TBI)是美国神经和神经精神障碍的主要原因。例如,TBI患者患有抑郁症的几率是普通人群的5-10倍,而30%的TBI患者显示出可检测的认知下降。最近,为活体检测TBI后的炎症,开发了可以与活化的小胶质细胞结合的PET可检测配体。长达17年后的TBI患者中检测到了与小胶质细胞上的苯二氮平受体结合增加的PK11195,并与认知处理速度受损相关。尽管目前没有针对TBI相关神经精神后遗症的药物疗法,但小胶质细胞在受伤后几个月到几年的稳态异常改变可能代表了治疗干预的机会。
小鼠的TBI模型中,小胶质细胞结构和中枢神经系统炎症的慢性紊乱已得到模拟。小鼠重复的闭合头部损伤导致了小胶质细胞(Iba1)的标记增加,与伤后12-18个月的海马依赖性学习障碍相一致。一系列的研究证实了受伤后小胶质细胞的炎症活化。
小胶质细胞参与多种稳态过程,包括突触修剪、免疫监测和碎片清除;因此,小胶质细胞稳态的长期破坏可能是受伤后的神经精神并发症和神经退行性疾病的根源。
大量组织学证据表明TBI后神经元和小胶质细胞之间存在动态结构关联。但是,TBI后小胶质细胞与神经元的结构互动的功能意义尚不清楚。
这项研究的主要目标是确定小胶质细胞是否是TBI后神经病理的驱动因素。研究人员之前的研究已经显示,在受伤前和受伤后7天通过CSF1R拮抗消除小胶质细胞可以预防中线FPI(mFPI)后多种免疫和炎症基因的表达。当前研究的目标是双重的:首先,了解从急性(1天)和亚急性(7天)到慢性(30天)损伤阶段小胶质细胞在神经病理基因表达进展中的作用;其次,了解小胶质细胞是否介导神经元对损伤的转录、结构和生理反应。研究人员的数据结果表明,小胶质细胞是慢性炎症的关键介质,并在转录、结构、生理和功能层面抑制神经元的稳态。
二、研究方法
1.实验动物
8-10周大的C57BL/6雄性小鼠从Charles River Breeding Laboratories购得。为了进行神经追踪和树突棘分析,从The Jackson Laboratory购得Thy1-YFP-H小鼠。
2.PLX5622给药
PLX5622由Plexxikon Inc.提供,并由Research Diets在AIN-76A啮齿动物饲料中配制成1200mg/kg的浓度。标准的AIN-76A饮食作为载体控制。为了在TBI前消耗小胶质细胞,小鼠连续14天随意进食PLX5622或载体饮食,并在整个研究期间继续这种饮食。实验室验证了这个剂量和时间可以在C57BL/6小鼠中消耗大约96%的小胶质细胞。
3.皮层微切分析NanoString
皮质微解剖用于NanoString 从包含肥大和棒状小胶质细胞的皮质微解剖区域提取RNA(Witcher et al., 2018)。在处死时,迅速取出大脑并在干冰冷却的异戊烷中快速冷冻。新鲜冷冻的组织交替切成30微米和200微米厚,然后贴在带电幻灯片上。薄片或导向片使用CD11b(1:300, 生物素化)标记,并使用ABC溶液(Vector Laboratories)和二氨基苯胺(DAB)过氧化物底物试剂盒(Vector Laboratories)进行可视化。使用标记的导向片在冷冻的厚切片中识别感兴趣的区域,然后进行微切割,立即裂解,并提取RNA(PicoPure RNA提取试剂盒,Thermo Fisher Scientific)。使用Agilent BioAnalyzer确认RNA的完整性,并使用housekeeping基因(Gapdh, Actb)的表达确定预放大周期;每个实验组5-9只小鼠。
附
美国NanoString 是继生物芯片技术和新一代测序技术(NGS)后在基因表达谱分析上展示出强大应用前景的新技术公司。其数字基因表达谱技术NanoString nCounter?分析系统,利用专利分子条形码及单分子成像技术,进行高通量多重基因表达研究,系统直接对多种样本中的转录本进行数字化检测。不需反转录及后续PCR扩增,产出数据精准稳定,可再现性高。其GeoMx DSP数字式空间多靶标分析系统,可实现组织切片水平多维度(RNA和蛋白水平)、多重(Multi-plex)位置信息挖掘
4.NanoString基因表达分析
使用NanoString neuropathology面板对基因表达进行定量,增加了30个自定义基因(NanoString Technologies)。首先根据制造商的协议对正负控制进行技术规范化。基于与总计数的强相关性验证了housekeeping基因,并使用七个基因对数据进行规范化(Aars, Asb7, Ccdc127, Cnot10, Csnk2a2, Lars, Mto1)。使用DESeq2在R中进行数据规范化和差异表达测试(Love et al., 2014)。使用ingenuity pathway analysis(IPA;QIAGEN)进行通路分析。原始的RCC文件和规范化的计数矩阵在NCBI的Gene Expression Omnibus(GEO;GSE160651)中可用;在扩展数据图1-2中提供了原始和规范化的计数。
5.皮层单细胞测序的解离:
小鼠用冰冷PBS灌注,大脑迅速取出,皮层进行显微切割。皮层用成年小鼠脑解离试剂盒(适用于小鼠和大鼠)按照制造商的说明进行解离,但有轻微的修改 (Miltenyi Biotec)。人造CSF (aCSF,如下所述) 用于制备酶溶液。切下的皮层立即放入预热(37°C)的酶P溶液中,加入酶A溶液,并在C管中在37°C下使用gentleMACS细胞解离器 (Miltenyi Biotec) 进行解离。密度离心法用于去除髓鞘碎片,剩余的红细胞被破裂,使用血细胞计数器确定细胞的活力和浓度。每组中的三只小鼠的皮层(Veh-Con,VehTBI,PLX5622-Con,PLX5622-TBI)被汇集到每个样本中。该实验重复两次,每个实验组使用了六只小鼠。每个皮层匀浆恢复约3000-7000个细胞。
10x Genomics单细胞RNA测序: 单细胞皮层悬浮液加载到10x芯片上,并在染色体控制器上运行以产生凝胶珠乳液(10x Genomics)。UMI条形码、cDNA扩增和文库构建的协议遵循10x Genomics单细胞3′ v2试剂盒的协议。利用Agilent高灵敏度DNA BioAnalyzer芯片确定文库质量,并使用Illumina HiSeq进行测序。使用CellRanger (10x Genomics) 将测序读取对齐到mm10小鼠基因组,并生成计数矩阵。NCBI的基因表达综览(GEO; GSE160763)提供了原始FASTQ文件和计数矩阵。使用Seurat在R中过滤低质量细胞(双峰、低计数、高计数) (Butler等人,2018年)。根据显著增加的基因表达将细胞类型分配给每个簇。从完整数据集中提取了Tmem1191 microglia、Gja11星形胶质细胞、Plp11髓鞘细胞和Meg31神经元,并进一步分析。使用Seurat (p-adj < 0.05) 确定了簇特异性表达和实验组之间的差异表达。扩展数据图3-2包含用于确定每种细胞类型的Veh-Con和Veh-TBI组之间的簇特异性标记物和差异表达的分析的原始输出
6.大脑皮层解离用于单细胞测序
小鼠用冰冷PBS灌流,大脑迅速取出,并对皮质进行微切割。使用Miltenyi Biotec公司的成年小鼠脑解离套件对小鼠和大鼠的皮质进行解离,按照生产商的说明进行了少量修改。人工脑脊液(aCSF,如下所述)用于制备酶溶液。切下的皮质立即放入预热(37°C)的酶P溶液中,添加酶A溶液,然后在37°C下使用gentleMACS解离器(Miltenyi Biotec)在C管中对组织进行解离。用密度离心法去除髓鞘碎片,溶解剩余的红细胞,使用血球计数仪测定细胞的活性和浓度。从每个实验组(Veh-Con,VehTBI,PLX5622-Con,PLX5622-TBI)的三只小鼠的皮层中汇集样本。这个实验进行了两次复制,因此每个实验组使用了六只小鼠。研究人员从每个皮质匀浆中回收了大约3000-7000个细胞。
7.10x Genomics单细胞RNA测序
单细胞皮质悬浮液装载到10x芯片上,在Chromium Controller上运行,生成凝胶珠乳状液(10x Genomics)。按照10x Genomics Single Cell 39 v2试剂盒协议进行UMI条形码、cDNA扩增和文库构建。使用Agilent High Sensitivity DNA BioAnalyzer芯片确定文库质量,并使用Illumina HiSeq进行测序。测序读数比对到mm10小鼠基因组,使用CellRanger(10x Genomics)生成计数矩阵。原始FASTQ文件和计数矩阵在NCBI GEO(GSE160763)中可用。使用Seurat in R(Butler等人,2018)过滤低质量的细胞(双体细胞、低计数、高计数)。基于显著增加的基因表达为每个簇分配细胞类型。从完整的数据集中提取了Tmem1191小胶质细胞、Gja11星形胶质细胞、Plp11少突胶质细胞和Meg31神经元,并进行了进一步的分析。使用Seurat确定簇特异性表达和实验组之间的差异表达(p-adj < 0.05)。扩展数据图3-2包含了确定簇特异性标记物和Veh-Con与Veh-TBI组之间的每个细胞类型的差异表达的分析结果的原始输出。
为确定PLX5622对TBI的逆转作用,确定受TBI影响的基因:(1)如果表达在PLX-TBI组中返回到基线(Veh-Con)水平,且Veh-TBI与PLX-TBI之间显著不同,则被认为是逆转的;(2)如果表达返回到基线(Veh-Con),但Veh-TBI和PLX-TBI之间不显著,则被认为是部分逆转的;(3)如果PLX-TBI与基线显著改变的方向相同,如Veh-TBI,则被认为是不受影响的。
8.复合动作电位 (CAP) 的记录
CAPs是根据之前的描述从体外切片准备中的胼胝体记录的 (Reeves et al., 2005)。简要地说,小鼠被异氟烷麻醉,然后被处死,大脑迅速切割到含有以下成分的冰冷切割溶液中:250 mM 蔗糖,25 mM D-葡萄糖,2.5 mM KCl,24 mM NaHCO₃,1.25 mM NaH₂PO₄,2.0 mM CaCl₂,1.5 mM MgSO₄ 和1.0 mM 喹啉酸 (pH 7.3–7.4)。使用振动切片机 (VT1200S, Leica) 准备400微米的整脑冠状切片。含有完整胼胝体的脑片被转移到填充了aCSF的室中,aCSF经95%氧和5%二氧化碳通气,并包含以下成分:124 mM NaCl,3 mM KCl,24 mM NaHCO₃,1.25 mM NaH₂PO₄,2 mM CaCl₂,1.0 mM MgSO₄,和10 mM D-葡萄糖 (pH 7.3–7.4)。允许它们在37°C下恢复30分钟,然后移到室温下至少1小时。切片被转移到室温下的浸没室中,并使用重力灌流系统进行溶液交换(2–3 ml/min),在记录期间使用含氧的aCSF灌流。填充aCSF的硼硅酸玻璃电极(1.5-3 MV)被定位在一个半球的胼胝体中央,通过放置在另一个半球的胼胝体中的定制扭曲镍铬丝刺激电极来记录通过电刺激诱发的CAPs。电极之间的距离约为1.5 mm。应用不同的刺激强度(0–2 mA,21 步骤,200 ms,每5秒)来诱发CAPs并创建强度-反应图。CAPs在1 kHz处低通滤波并以50 kHz数字采样。所有数据使用Axopatch 200B放大器,Digidata 1440A 和pClamp 10.6软件 (Molecular Devices) 数字化。使用Clampfit 10.6软件从典型的迹线在线监测和离线分析数据;每组6只小鼠;从每只小鼠的三到四片脑片中平均得到N1、N2 和 N2/N1 比值。然后使用小鼠的平均值计算组均值和误差。代表性的迹线是通过最大刺激诱发的。
9.神经元追踪和树突棘分析
树突复杂性是根据之前描述进行确定的,但进行了少量修改 (Hao et al., 2016; Chunchai et al., 2018)。简而言之,使用Thy1-YFP-H小鼠,因为约10–12%的第V层皮层神经元表达YFP并允许观察小的神经结构 (Feng et al., 2000)。小鼠受伤、灌注、固定,然后大脑被切成30微米厚的皮质切片。使用Leica SP8共焦显微镜 (Leica Biosystems) 从皮质第IV/V层获取z堆栈的系列。通过Imaris软件7.0 (Oxford Instruments) 分析神经元形态。每个脑片评估三个神经细胞,每只小鼠评估三个脑片,每组6只小鼠。全神经元被追踪,使用Imaris软件进行Sholl分析来评估过程的分支/复杂性。与Sholl半径相比,交点的数量被绘制,并从3D结构计算曲线下面积。此外,为了确定树突棘密度,使用三个三级片段随机测量树突棘密度。每10微米的树突段量化YFP+树突,并使用Imaris进一步分类为蘑菇或短粗的棘。
大脑皮层的分层
大脑皮层主要分为分子层、外颗粒层、外锥体层、内颗粒层、内锥体、多形细胞层。大脑皮层的1-4层主要接受传入的冲动。
皮层细胞的纵向柱状排列构成大脑皮层的最基本功能电位,称为感觉柱(sensory column)。这种柱状结构的直径为200-500μm,垂直走向脑表面,贯穿整个六层。同一柱状结构内的神经元都具有同一种功能,例如都对同一感受野的同一类型感觉刺激起反应。在同一刺激后,这些神经元发生放电的潜伏期很接近,仅相差2-4ms;说明先激活的神经元与后激活的神经元之间仅有几个神经元接替;亦说明同一柱状结构内神经元联系环路只需通过几个神经元接替就能完成。一个柱状结构是一个传入-传出信息整合处理单位,传入冲动先进入第四层,并由第四层和第二层细胞在柱内垂直扩布,最后由第三、第五、第六层发出传出冲动离开大脑皮层。第三层细胞的水平纤维还有抑制相邻细胞柱的作用;因此一柱发生兴奋活动时,其相邻细胞柱就受抑制,形成兴奋和抑制镶嵌模式。这种柱状结构的形态功能特点,在第二感觉区、视区、听区皮层和运动区皮层中也一样存在。
10.运动活动的Rotarod和悬挂线评估
之前描述的加速Rotarod测试进行了 (Fenn et al., 2014)。简而言之,确定从加速Jrotarod上掉落的潜伏期。旋转速度从4 rpm开始,加速到40 rpm超过200秒。小鼠每天有三次尝试,这些被平均。培训是在mFPI之前的3天,最后一天计为基线性能。测试是在TBI后的1dpi和每周一次。像之前描述的那样进行了水平条杆悬挂测试 (Deacon, 2013)。简而言之,将前爪放在一个6毫米直径的硬线上,这个线被升高在一个垫子上,并确定小鼠逃到一个距离20厘米的平台上的潜伏期。在这次测试中,没有小鼠从线上掉下来;每个实验组6只小鼠。
11.新物体位置(NOL)和识别
之前描述的NOL和识别进行了 (Denninger et al., 2018) 但进行了少量修改。这些测试涉及每个分隔24小时的四个10分钟阶段:习惯化(没有物体),适应(两个物体),位置(两个物体,一个新位置)和识别(两个物体,有一个新物体)。试验被录制,并通过一个盲审者测量每个物体的调查时间。对于位置和识别试验,计算鉴别指数如下:[(新时间 – 熟悉时间)/总时间] * 100;每个实验组10只。
12.实验设计和统计分析
每个实验中的小鼠数量包括分析的切片/细胞/图像数量都包含在上述每个实验的方法中。使用DESeq2或CellRanger分别描述上述的NanoString和单细胞RNA-测序(scRNAseq)的统计分析。用于组织学、行为和电生理数据的ANOVA的IBM SPSS统计(版本24)。使用适当的方法确定主效应和因素之间的交互。当确定主效应和/或交互时,用于事后分析的最小平方差 (LSD),并认为p < 0.05是统计学上显著的。
三、研究结果
1.依赖于小胶质细胞和不依赖于小胶质细胞的皮层基因表达在1、7、30天后的损伤中发生差异性变化
研究人员之前报道,通过CSF1R拮抗剂PLX5622消除小胶质细胞可以逆转炎症相关基因的mRNA表达,并减少皮层7天后的损伤中形成独特的棒状小胶质细胞(Witcher等,2018)。在这里,研究人员试图确定小胶质细胞对急性(1 dpi)、亚急性(7 dpi)和慢性时间点(30 dpi)皮层神经病理学的贡献。通过口服PLX5622 14天来消除小胶质细胞,然后在实验期间维持实验饮食(Veh或PLX5622)。在每个终点,收集大脑,切片,并用抗Iba1标记。如预期(Elmore等,2014;Witcher等,2018),在基线,PLX5622给药后Iba11小胶质细胞的数量显著减少(F(1,31)=1658, p<0.001; 图1B,C) 和在1、7、或30 dpi (F(3,31) = 4.3, p = 0.015)。切片与P2RY12共标,超过99%的Iba1+细胞也是P2RY121+(数据未显示)。总体来说,在PLX5622给药期间小胶质细胞被消耗。
在另一项实验中,收集大脑并冷冻切片,用抗-CD11b标记以可视化小胶质细胞。根据在引导切片上发现的反应性或杆状小胶质细胞,在冷冻的同时对相邻厚切片的相应皮层区域进行显微解剖 。伤后微切皮层中与神经病理学相关的基因表达分析(NanoString神经病理学nCounter面板,760个基因加30个自定义基因)显示,基因的差异表达受到伤害、时间和小胶质细胞消耗的影响(图1D)。例如,1 dpi时有114个差异表达的基因(76个增加和38个减少)。在7 dpi有61个差异表达的基因(40个增加和21个减少),在30 dpi有29个差异表达的基因(18个增加和11个减少)。图1D突出了那些与PLX独立(白色条)或依赖于PLX (p<0.05, 黑色条)的TBI诱导的基因。在1 dpi,只有33%的由TBI影响的基因通过小胶质细胞消耗被逆转。被小胶质细胞消耗(PLX5622)影响的TBI诱导基因的贡献在7 dpi增加到66%,在30 dpi增加到80%。综上所述,TBI后的急性基因表达主要与小胶质细胞无关, 而神经病理mRNA表达的持续变化依赖于小胶质细胞。
接下来,IPA被用来鉴定这些差异表达基因的经典信号通路和上游调节因子。IPA的原始输出包括在扩展数据图1-3。然后使用IPA比较分析来比较伤后时间点(1, 7, 30 dpi)和治疗条件(Veh, PLX5622; 图1E)的通路变化。与神经炎症相关的经典通路在1, 7, 和30 dpi被维持。在急性和亚急性时间点(1和7 dpi)增加的其他显著的经典通路包括p38信号、NO和ROS产生以及HMGB1信号。在急性和亚急性伤害的两个阶段,TBI后LXR/RXR通路被抑制。这些TBI的通路级效应通过小胶质细胞的消耗被缓解。
IPA上游调控因子分析(p < 0.05;绝对z得分 > 2)揭示了TBI和小胶质细胞消耗的相似效应。这种分析预测可能解释基因表达观察模式的信号通路。在急性和亚急性时间点(1和7 dpi)的表达模式与升高的细胞因子(IL-6, TNF, IL-1b)和干扰素(IFNa, IFNb, IFNg)信号一致。其中,与对照组相比,TNF相关基因在30 dpi仍然增高。在1和7 dpi,有一个与TBI关联的APOE和SOCS1通路的抑制。总体来说,这些TBI后的表达模式在没有小胶质细胞的小鼠中不存在,并且与对照组显示相反的表达模式(如图1E,底部面板所示)。
有和没有PLX5622的情况下的基因表达模式证实了组织学上小胶质细胞的减少的证据。图1F显示了受TBI和PLX影响的与小胶质细胞相关的基因的热图,分别为1、7或30 dpi。例如,PLX5622对包括Tmem119、Cx3cr1、Csf1r、C1qc、Trem2和Itgam(CD11b)在内的大多数与小胶质细胞相关的基因产生了主要影响(p,0.05)。与TBI(p,0.05)相关的小胶质细胞相关基因Il10ra、Gpr84、Cd68、Cd14、Ccr5、Cd33和Nlrp3在TBI前已经减少的小鼠中受到了抑制。值得注意的是,一些其他与小胶质细胞/髓样细胞相关的基因,如Ccr7、Il1b、H2-Eb1和Ccl2,在不考虑PLX5622的情况下也受到TBI(p,0.05)的影响。与PLX-Con小鼠相比,PLX-TBI小鼠在30 dpi时表现出了一些与小胶质细胞相关的基因的升高,包括Cd68、Cd14和Trem2。这可能与PLX-TBI小鼠在30 dpi时脑内小胶质细胞相对扩增有关(图1C)。总的来说,大多数与小胶质细胞相关的炎症反应在TBI前后小胶质细胞被清除时在1 dpi被阻断,而在7 dpi和30 dpi时保持低水平。
2.在皮质中的炎症mRNA表达随着1、7和30 dpi的进展而发展
与图1中呈现的数据相关,图2A中的热图突出了TBI和时间对与神经病理学相关的基因的交互作用,部分反映出在1(顶部)、7(中部)和30(底部)dpi显著差异表达的基因(p < 0.05)。图2B反映了在多个时间点差异表达的基因。总体上,伤害、时间和小胶质细胞消耗(PLX5622)都有影响。皮质中差异mRNA表达的最高水平是在1 dpi。急性期,与对照组相比,TBI增加了几种与炎症相关(Cd14、Cd68、Gpr84、Myd88、Tnf)、干扰素相关(Irf7、Ifi2712a)和趋化因子相关(Ccl12、Ccl3、Cxcl10、Cxcl16)的转录物(p < 0.05)。这些与TBI相关的1 dpi的增加被PLX5622减弱(p < 0.05)。尽管如此,高水平的基因表达(66%;图1D)不受PLX的影响。例如,TBI增加了Icam1、Ptgs2、Ccl2、Cd44、Gfap、Atf3、Osmr、Nex、胶原组分(Col4a1、Col4a2和Col6a)和基质金属蛋白酶(Mmp12、Mmp14和Mmp19)。这些基因在1 dpi的增加不受小胶质细胞消耗的影响。因此,皮质中1 dpi的mRNA差异表达大部分与小胶质细胞无关。
然而,随着时间的推移,受TBI和小胶质细胞影响的基因数量增加。这在按时间组织的热图中很明显(图2A)。在7和30 dpi差异表达的基因在图2C、D中总结,Barres实验室的大脑RNA-seq Mus musculus (www.brainrnaseq.org)数据集被用来近似表示那种细胞类型表达了哪种基因。在7 dpi,与对照组相比,几种与炎症相关(Cd14、Cd68、Gpr84、Clec7a、Itgax、Tlr4、Trem2)、干扰素相关(Irf7、Ifi2712a)和趋化因子相关(Ccl12、Ccl3、Cxcl10、Cxcl16)的转录物增加(p < 0.05),并通过小胶质细胞的消耗而逆转(p > 0.05)。皮质中还有几种在7 dpi(p < 0.05)减少的基因,包括与神经元相关的基因(Adcy8、Cxc3rl、Drd2、Htr1a、Ngf、Slc18a3和Trpv1),这些基因通过小胶质细胞的消耗而被阻止(p > 0.05)。
在30 dpi,与对照组相比,几种与先天免疫相关的转录物(Cd14、Cd68、Gpr84、Itgax、Tlr4、Trem2)因TBI而增加(p < 0.05),并通过小胶质细胞的消耗而逆转(p > 0.05)。皮质中还有几种在30 dpi(p < 0.05)减少的基因,包括与神经元相关的转录物(Avp、Drd1、Drd2),这些减少再次通过TBI前小胶质细胞的消耗而逆转(p > 0.05)。
在30 dpi的另一个值得注意的观察是,与Veh-TBI相比,TBI-PLX组中有几种基因增强。这些数据可能表明,当小胶质细胞被消耗后,TBI后星形胶质细胞有了补偿/扩张。为了支持这一观点,在PLX-TBI组与Veh-TBI组相比,Aldh1l1、Cd44、Gfap和Aqp4的相对mRNA表达更高(p < 0.05;图2D)。扩展数据还显示,在TBI-PLX组与TBI-Con组30 dpi(扩展数据图1-1)中,GFAP标记增加。
3.TBI后皮质细胞的单细胞测序。皮质mRNA分析显示,小胶质细胞对于伤后持续的神经炎症途径有着强烈的贡献。
这些数据还表明,TBI后亚急性和慢性时间点的持续炎症可能影响周围的神经元、少突胶质细胞和内皮细胞。为了调查这一假设,采用了单细胞测序方法来确定伤后7天皮质内有无小胶质细胞消耗的细胞类型特异性基因表达(图3A)。从显微解剖的皮质中产生的汇聚的单细胞悬浮液,使用10x Genomics流程进行单细胞mRNA测序。基于细胞选择性基因表达的聚类可以明显地看到不同的中枢神经系统细胞类型(图3B,C)。例如,小胶质细胞(Tmem119)、星形胶质细胞(Gja1)、少突胶质细胞(Plp1)、神经元(Meg3)和内皮细胞(Ly6c1)都形成了不同的簇(图3C)。图3D中的点图和扩展数据图3-1表示了所有36,000个测序细胞在所有四个实验组(Veh-Con、Veh-TBI、PLX-Con、PLX-TBI)中的分布。扩展数据图3-1突出显示了Veh处理组和PLX处理组之间小胶质细胞数量的差异。此外,对小胶质细胞(12,181细胞)和神经元(2878细胞)种群进行了子聚类以进行进一步分析。子聚类的点图显示了小胶质细胞(图3E)和神经元(图3F)的细胞分布情况。
![图片[2]-文献学习2:创伤性脑损伤导致由小胶质细胞介导的慢性皮质炎症和神经元功能障碍-吃了吃了](https://cdn.ineuro.net/cloudreve%2F2023%2F09%2F08%2F5GUTLjD1_wx2-1.png)
4.创伤相关的mRNA特征和TBI后皮质小胶质细胞中增加的type-1干扰素信号
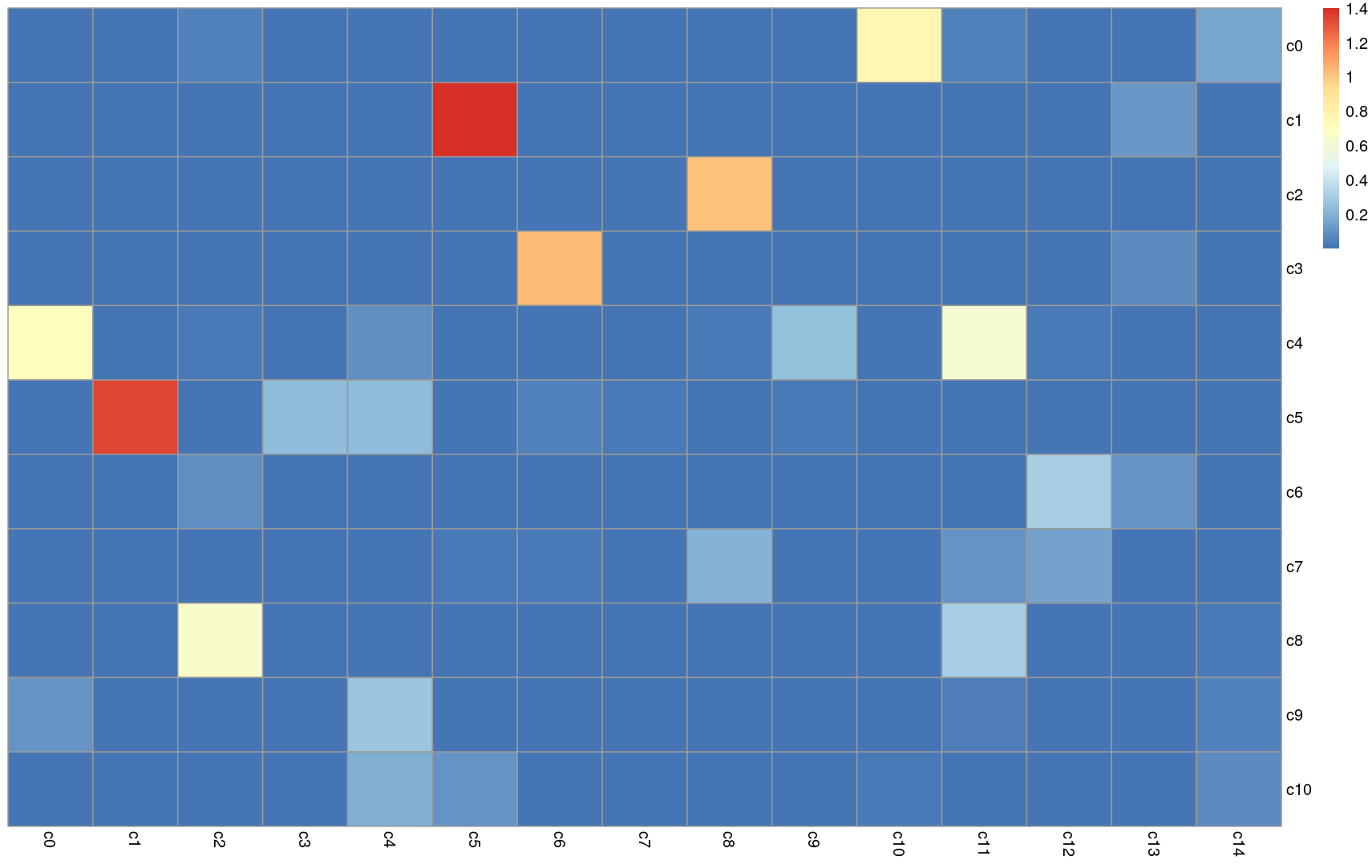
首先,小胶质细胞的子聚类揭示了10个(0-9)由每个细胞的转录组确定的明显的小胶质细胞簇(图4A)。图4B显示了每个簇中的细胞总数,以及来自每个实验组(Veh-Con、Veh-TBI、PLX-Con、PLX-TBI)的细胞比例。这里,PLX5622和TBI依赖的基因表达模式是明显的。提供了一个代表性的热图,显示定义每个簇的基因表达(扩展数据图4-1)。饼图(图4C)反映了每个实验条件下每个簇的小胶质细胞比例。每个实验组中过度代表的簇中的基因被列出,并在与所有其他小胶质细胞相比时,显著高表达(p-adj < 0.05)。例如,簇3(绿色)主要在Veh-Con小鼠的皮质小胶质细胞中表示(图4B,C)。簇3的小胶质细胞表达了更高水平的稳态小胶质细胞基因,包括Cx3cr1和Tgfbr1。簇2的小胶质细胞(军绿色)占了PLX-Con和PLX-TBI小胶质细胞的约50%,并在Veh-TBI组中富集。簇2高度表达编码核糖体蛋白的mRNA,这可能表明增加的增殖或代谢负担。簇7也被PLX处理丰富。簇7表达增殖相关的基因,包括泛素连接酶E2C(Ube2c)和着丝粒蛋白A(Cenpa),以及细胞骨架成分,包括与微管相关和与肌动蛋白相关的基因。因此,簇2和7可能代表小胶质细胞的活跃转换。
![图片[3]-文献学习2:创伤性脑损伤导致由小胶质细胞介导的慢性皮质炎症和神经元功能障碍-吃了吃了](https://cdn.ineuro.net/cloudreve%2F2023%2F09%2F08%2FPQcqEjPH_wx2-2.png)
TBI对小胶质细胞亚群的影响与增加的炎症和1型干扰素信号有关。例如,簇6(蓝色)主要来源于Veh-TBI皮层的小胶质细胞,这些细胞高度表达干扰素应答基因(Ifitm3、Isg15、Ifi27l2a)以及其他免疫相关基因(Ccl12、Cd63、Cd52、H2-D1和H2-K1)。此外,簇8(紫色)也在Veh-TBI组中富集,并包含增加的与干扰素相关的(Ifi27l2a)和与损伤相关的基因(Cd52、Flt1、Tsmb4x、Apoe)。另外,簇9(粉红色)在Veh-TBI和PLX-TBI组中富集,并有增加的Cd52、Clec7a、Apoe和Trem2表达。随着TBI(7 dpi)的增加,VehCon组中明显的更多稳态基因(簇3和4)在TBI后成比例减少。这些数据与皮质mRNA分析中明显的增加的干扰素途径(图1E)是一致的。
图4D进一步强调了簇特异性的表达模式,显示了与小胶质细胞稳态相关的基因(Tgfbr1、P2ry12、Cx3cr1、Tmem119)、小胶质细胞对损伤的反应中涉及的基因(Trem2、Apoe、Clec7a、Cd52)以及干扰素应答基因(Ifitm3、Irf7、Ifi27l2a、Stat1)。点图显示了按簇的相对基因表达(颜色强度)和每个簇表达基因的细胞比例(点大小)。具有更多炎症基因表达的簇相应地减少了先前描述的稳态基因表达(Krasemann等,2017)。例如,TBI富集的簇,簇6,Cd52、Ifitm3、Irf7、Ifi27l2a和Stat1的表达相对增加,与稳态基因,包括Tgfb1、Cx3cr1和Tmem119相应地减少(图4D)。此外,与疾病相关的簇(Krasemann等,2017; Deczkowska等,2018),簇9,有增强的Trem2、Apoe、Clec7a、Cd52与包括Tgfb1、Cx3cr1和Tmem119的稳态基因相应地减少(图4D)。
当Veh-Con和Veh-TBI组在所有簇中进行比较时,66个基因有显著的差异表达(p-adj<0.05;43个增加,23个减少)。图4E显示了这些TBI依赖的基因的选择。对Veh-Con和Veh-TBI样本之间小胶质细胞中66个差异表达的IPA上游调节因子分析与7dpi时作为TBI功能的增加的1型干扰素信号一致。例如,7dpi小胶质细胞中受影响的上游调节因子包括增加的IFNA、IRF3、IFNAR和STAT1。因此,7dpi时小胶质细胞中有一个强烈的与干扰素相关的表达模式。更具体地说,与创伤富集的簇6对1型干扰素信号高度反应。这可能反映了皮层7dpi的持续炎症和细胞损伤。总体而言,有5个小胶质细胞簇在特定治疗组中富集(图4G)。
IPA分析
IPA 是基于QIAGEN近20年收集整理的QIAGEN Knowledge Base 开发的一款组学数据分子机理挖掘工具。可以对基因、蛋白、代谢物、药物和化合物等进行生物学功能和分子调控机理的解读,阐明生物学现象背后的分子机理、挖掘潜在的生物学标志物。
IPA的分析结果可以分为六个模块:经典通路分析、上游分析、疾病与功能分析、调控效应分析、相互作用网络、图形摘要。
上游分析
分析基因表达数据时的一个关键问题在于,探究哪些上游分子可能驱动数据集中的基因或转录本表达变化。IPA会预测哪些上游调节因子被激活或抑制,导致了数据集中上调和下调的基因。
5.TBI诱导炎症和反应性星形胶质细胞特征,而小胶质细胞的减少部分阻止了这一过程。
对Gja+星形胶质细胞的进一步分析揭示了所有四个实验组中的七个(0-6)细胞簇(图5A)。图5B和5C突显了在特定星形胶质细胞簇中强烈表达的基因。例如,簇5与高Gfap表达相关,与反应性星形胶质细胞一致,而Spry2则与BDNF信号和神经突起生长有关。这些发现与以前的报告一致,即星形胶质细胞保持异质性的细胞表面标记,并在成人CNS中具有多种功能。
在7dpi的Gja+星形胶质细胞中,有55个基因的表达发生了差异(Veh-Con与Veh-TBI之间,p-adj<0.05)。其中,27个在TBI后增加(图5D),28个减少(图5E)。所有差异表达的基因都在图5D和5E中表示,其中点图反映了按治疗组的相对基因表达(颜色强度)以及每个簇中表达基因的细胞比例(点的大小)。增加的基因包括与星形胶质细胞反应性在伤害/疾病中相关的Gfap、Apoe和Clu。此外,与生长因子信号(Vegfa, Fgfr3)和细胞外基质重塑(Bcan)以及星形胶质细胞Notch信号(Lfng, Nrarp)相关的基因的表达减少。差异表达的基因被用于IPA分析,三个上游调节器在伤害后显著不同(p<0.05;图5F)。值得注意的是,与TBI诱导的基因表达一致,CEBPB信号增加,这是一个调节星形胶质细胞中炎症基因表达的转录因子。在7dpi的55个差异表达的基因中,82%(45个基因)的这种特征在PLX-TBI组与Veh-TBI相比得到了逆转(p<0.05;图5G)。总的来说,这些数据表明,星形胶质细胞采纳了一个炎症和反应性的特征,其特点是增加的炎症和减少的稳态基因表达,而这种特征通过小胶质细胞的减少得到了减弱。
![图片[4]-文献学习2:创伤性脑损伤导致由小胶质细胞介导的慢性皮质炎症和神经元功能障碍-吃了吃了](https://cdn.ineuro.net/cloudreve%2F2023%2F09%2F08%2FBNNUiFf4_wx2-3.png)
6.髓鞘形成的少突胶质细胞在TBI后发生与髓鞘形成和CNS损伤反应一致的转录变化,而这一变化被小胶质细胞的消耗所减弱。
进一步分析Plp1+细胞揭示了九个(0-8)簇(图6A)。图6B和6C突出显示了与其他Plp11细胞相比在特定种群中增加的少突胶质细胞基因。例如,Mobp和Mog在髓鞘形成的少突胶质细胞簇(0-4,6,8)中高度表达,而Pdgfra在少突胶质细胞前体细胞(OPCs; 簇5)中高度表达。簇7由表达与少突胶质细胞成熟有关的基因(如Slc1a1, Gpr17, Bcan)的细胞组成,并降低了髓鞘形成基因Mog和Mobp的表达。
TBI后,在髓鞘形成的少突胶质细胞中有39个差异表达的基因(Veh-Con与Veh-TBI比较,padj<0.05)。其中,15个在7dpi时增加(图6D),24个减少(图6E)。所有差异表达的基因都在图6D和6E中表示,其中点图反映了按治疗组的相对基因表达(颜色强度)以及每个簇中表达基因的细胞比例(点的大小)。增加的基因包括那些编码四跨膜蛋白(如Cd9, Cd81)的基因,这些基因与少突胶质细胞的发展有关,并与少突胶质细胞对CNS损伤/应激的反应相关的基因(如Apod, Hspa8)。在39个差异表达的基因中,有32个被小胶质细胞消耗所逆转(图6F)。尽管在少突胶质细胞中差异表达的基因数量相对较少,但在TBI后还是可以检测到取决于小胶质细胞的变化。
![图片[5]-文献学习2:创伤性脑损伤导致由小胶质细胞介导的慢性皮质炎症和神经元功能障碍-吃了吃了](https://cdn.ineuro.net/cloudreve%2F2023%2F09%2F08%2FGDLMHcld_wx2-4.png)
7.TBI与7 dpi的神经元稳态降低有关,而这种降低通过小胶质细胞消耗得到了缓解。
接下来,分析了Meg3+皮层神经元(2878个),并确定了十一个(0-10)不同的簇(图7A;扩展数据图7-1显示的表达热图)。图7B突出显示了神经元特异性基因(Meg3,Camk2n1)和与突触神经元(Thy1,App)、抑制性神经元(Gad1)或轴突运输(Kif5a)相关的基因。四个实验组中每个簇的比例在簇之间相对一致(扩展数据图7-2)。
总体上,7 dpi的Meg3+皮层神经元中有233个差异表达的基因(Veh-Con与Veh-TBI比较)。其中,95%(221个基因)减少,5%(12个基因)增加(p-adj<0.05;图7C)。
利用差异表达的基因进行IPA分析,几个经典通路的抑制是明显的(图7D)。例如,7 dpi时钙信号、突触生成和突触长时程增强都被抑制(每个的p<0.00003)。此外,7 dpi时突触长时程抑制和谷氨酸受体信号增加(p<0.0001)。皮层神经元的上游调控因子分析显示在图7E中(p<0.05;绝对z分数>2)。
TBI后的神经元基因表达与生长和存活(TGFB,MKNK1,IGF1)、神经突起生长(NRF1)和细胞应激调控(XBP1,ATF6,NFE2L2)相关的调控因子的减少表达一致。驱动这些通路级变化的关键基因在图7F中显示,通过治疗组(颜色强度)和每个簇中表达基因的细胞比例(点的大小)表示相对基因表达。与Veh-Con相比,Veh-TBI中所有编码谷氨酸AMPA受体亚基的基因(Gria2,Gria3,Gria4)都增加(p-adj<0.05;图7E)。所有其他神经元基因都被抑制。例如,与钙稳态和信号传导相关的基因(Ryr2,Calm1,Caly)在TBI后的皮层神经元中减少。
与Veh-TBI相比,大多数基因表达的变化在PLX-TBI组中得到了逆转(p<0.05)。例如,用PLX5622消耗小胶质细胞减弱了皮层神经元中95%的TBI依赖性转录变化(图7G)。在TBI后差异表达的233个基因中,193个基因的表达模式恢复到Veh-Con水平,28个部分逆转。每个类别的选定基因在图7G中显示。与神经元可塑性和囊泡运输相关的基因(Nsg1,Syt5,Arf5)以及神经元调控小胶质细胞的基因(Cx3cl1,Cd200)在TBI后被抑制(p-adj<0.05),并通过小胶质细胞消耗得到逆转(p<0.05)。总体来说,这些数据表明,在TBI后7天,支持神经元稳态功能的基因在小胶质细胞依赖的方式下被抑制。
![图片[6]-文献学习2:创伤性脑损伤导致由小胶质细胞介导的慢性皮质炎症和神经元功能障碍-吃了吃了](https://cdn.ineuro.net/cloudreve%2F2023%2F09%2F09%2FO51omh7I_wx2-5.png)
8.TBI后的树突复杂性减少可以通过小胶质细胞的消除得到缓解
研究人员目前和之前的RNA和scRNAseq分析研究表明,小胶质细胞介导慢性炎症和潜在的病理(Witcher等,2018),并且与神经元稳态相关的途径减少了。其他研究表明小胶质细胞参与树突重塑和调节突触(Schafer等,2012)。因此,在TBI(7 dpi)后,研究人员评估了有或没有小胶质细胞消耗的Thy1-YFP-H小鼠皮层的神经元形态和脊突密度(图8A)。这里,研究人员展示了在皮层7 dpi的神经元复杂性(Sholl交叉点)减少了(F(3,80) = 2.912, p = 0.0273;图8B-D)。更重要的是,在TBI之前消除了小胶质细胞的小鼠中,这种效应不存在。研究人员还评估了Thy1-YFP-H小鼠的树突脊突密度(图8E),并且在TBI后总树突脊突密度没有差异(图8F)。然而,7 dpi的蘑菇(或成熟的)脊突确实显著减少(F(3,57) = 0.4471, p = 0.0169;图8G),与对照组相比,短粗的(不成熟的)脊突相应增加(F(3,57) = 0.4471, p = 0.0245;图8G)。在PLX-TBI小鼠中,未检测到TBI(Veh-TBI)引起的蘑菇型(成熟型)棘的减少和短粗型(未成熟型)棘的增加,这表明小胶质细胞的消除阻止了TBI相关的皮层树突在7 dpi时的重塑。
9.与TBI相关的30 dpi CAP损伤取决于小胶质细胞
研究人员提供了7 dpi和30 dpi炎症和神经病理的新型mRNA证据,并证明TBI后小胶质细胞会影响神经元RNA的表达。胼胝体包含来自皮层层的神经元的轴突,这些神经元在弥漫性TBI后受到损伤(Ramos等,2008)。因此,研究人员在有或无小胶质细胞的情况下检查了7和30 dpi通过胼胝体的神经连接性(图9A)。CAPs在胼胝体的大脑切片中被刺激和记录(图9A)。代表性的迹线显示了具有控制和TBI的动作电位的不同的N1和N2组成部分。这些数据被解释为表明N1代表快速传导纤维(大的,髓鞘化)和N2代表慢速传导纤维(小的,无髓鞘化)。每个治疗组的动作电位的N1和N2组成部分在7和30 dpi上显示(图9B,C)。7和30 dpi的N2 CAPs倾向于由于TBI而减少(各p=0.08;图9C)。TBI的主要效应是在7 dpi和30 dpi抑制N2/N1比率(F(4,32)=5.5,p= 0.002;图9D)。事后分析证实,与对照组相比,接受TBI的小鼠在7 dpi和30 dpi的N2/ N1比率减少(7dpi的p<0.001;30dpi的p= 0.018)。在7dpi时,N2/N1比率的抑制不受小胶质细胞消耗的影响(PLX-TBI 7dpi与对照p<0.001)。到30 dpi时, tbi诱导的N2/N1 比值在plx治疗小鼠中不再明显降低(PLX-TBI 30 dpi vs对照组p = 0.712)。最大刺激下(2 mA),TBI的效应及在30 dpi的PLX逆转作用显而易见,PLX-TBI小鼠的N2/N1比率处于对照水平,但Veh-TBI小鼠则不是(p= 0.02;图9E)。因此,TBI后CAP在慢性时间点(30 dpi)的损伤取决于小胶质细胞。
与TBI相关的30 dpi记忆缺陷取决于小胶质细胞。研究人员寻求确定由小胶质细胞引起的皮层依赖的感觉运动和认知行为在30 dpi内是否受到影响(图10A)。为确定感觉运动功能,使用了加速的Rotarod和水平杆测试。这些测试需要整合感觉和运动输入,并依赖于完整的皮层功能(Cao等,2015)。然而,加速的Rotarod(图10B)或mFPI后逃离水平杆测试的潜伏期(图10C)中,TBI或PLX5622都没有影响感觉运动功能。还检查了其他的感觉运动行为,但没有检测到TBI或PLX的持久效应(数据未显示)。因此,弥漫性TBI后,没有主要的长期运动或平衡缺陷。在30和31 dpi,分别确定了NOL和新物体识别(NOR)。NOL/NOR是依赖于完整的海马和皮层功能的认知评估(Antunes和Biala,2012)。测试的第一阶段检查了物体的位置(海马),第二阶段检查了NOR(皮层;图10A)。在任何测试阶段,四个实验组之间在探索的总时间上没有显著差异(图10D,G)。在“位置”测试阶段,TBI和PLX干预之间有一种相互作用的倾向(F(1,40)=3.65,p= 0.063)。事后分析证实,与所有其他组相比,Veh-TBI小鼠在新的位置上花费的时间相对较少,包括与PLX-TBI小鼠相比(与Veh-Con p<0.001;与PLX-Con p = 0.001;与PLX-TBI p = 0.026;图10E)。这些效应在NOL的鉴别指数中也很明显(图10F),表明Veh-TBI小鼠在熟悉的位置上与物体共度的时间明显更长。与新位置试验相似,TBI和PLX给药之间存在相互作用(F(1,39) = 18.7,p = 0.0001)用于NOR测试的方面。事后分析证实,与所有其他组相比,Veh-TBI小鼠探查新物体的时间较少,包括与PLX-TBI组相比(与Veh-Con p<0.001;与PLX-Con p<0.001;与PLX-TBI p<0.001;图10H)。这些差异在Veh-TBI小鼠与所有其他组相比都被抑制了的新物体的鉴别指数中反映出来(图10I)。PLX-TBI小鼠没有这些在探查新物体的时间或鉴别指数中的减少。总的来说,这些数据表明,TBI引起的皮层/海马记忆在30 dpi时下降,这取决于小胶质细胞。










暂无评论内容