Title: Enhancing endocannabinoid signalling in astrocytes promotes recovery from traumatic brain injury
DOI: https://doi.org/10.1093/brain/awab310
创伤性脑损伤是阿尔茨海默病和痴呆症发展的一个重要风险因素。目前还没有有效的预防和治疗创伤性脑损伤引发的类似阿尔茨海默病的神经退行性疾病的疗法。药物抑制单酰甘油脂酶(一种降解内源大麻素2-花生四烯酸甘油酯的关键酶)可以减轻创伤性脑损伤引发的神经病理。然而,导致创伤性脑损伤中单酰甘油脂酶抑制产生神经保护作用的机制尚不清楚。
该研究首次展示了单酰甘油脂酶基因敲除减少了小鼠在反复轻度闭合头部损伤暴露下的神经病理,并避免了突触和认知下降。这些神经保护效应主要是由于抑制星形胶质细胞中的2-花生四烯酸甘油酯代谢,而不是在神经元中。单细胞RNA测序数据显示,星形胶质细胞中的单酰甘油脂酶敲除小鼠在创伤性脑损伤引发的与炎症或脑内稳态维持相关的基因表达变化方面表现出更强的抗性,这影响了星形胶质细胞和小胶质细胞。通过大麻素受体-1的敲除或通过腺相关病毒载体介导的星形胶质细胞过氧化物酶体增殖激活受体-c的沉默,单酰甘油脂酶灭活产生的神经保护效应被取消。在星形胶质细胞中过表达过氧化物酶体增殖激活受体-c可以预防创伤性脑损伤引发的神经病理和空间学习和记忆障碍。
一、研究背景
内源大麻素系统包括内源大麻素、内源大麻素受体(CB1R和CB2R),由Δ9-四氢大麻酚,大麻的主要精神活性成分,所靶向的受体、合成和降解内源大麻素的酶以及转运体,参与了多种生理、药理和病理过程。2-花生四烯酸甘油酯(2-AG)主要由二酰甘油脂酶(DAGLa和DAGLb)从二酰甘油合成,是最丰富的内源大麻素,对抗炎症并在面对促炎、兴奋毒性和机械性伤害时具有神经保护作用。早期研究表明,2-AG对闭合头部损伤(CHI)具有神经保护作用,并减轻了TBI引发的神经病理,表明2-AG是一种“按需制造”的重要内源信号介质,维护脑内稳态,抵御有害侵害。然而,2-AG是一种生物活性脂质介质,一旦生成就会迅速降解,包括单酰甘油脂酶(MAGL)、a/b水解酶结构域含有的蛋白质6和12(ABHD6/12)以及环氧合酶-2(COX-2)在内的多种酶都能降解2-AG,但估计大脑中85%的2-AG是通过MAGL水解的。2-AG的即时代谢产物是花生四烯酸,是前列腺素和白三烯的前体,分别由环氧合酶-1/2和花生四烯酸5-脂氧合酶(LOX)催化生成。前列腺素(如PGE2)和白三烯似乎是神经退行性疾病的促炎介质。这表明通过抑制MAGL,增强2-AG的抗炎和神经保护信号,同时降低促炎和神经毒性的花生四烯酸介质水平,可能是治疗炎症性和神经退行性疾病的有希望的策略。事实上,以前的研究表明,MAGL的药物抑制可以缓解神经炎症、减轻神经病理,改善多种脑疾病的动物模型中的突触和认知功能,包括阿尔茨海默病、肌萎缩性侧索硬化、癫痫、多发性硬化症和帕金森病。最近的几项研究结果进一步证明,药物抑制MAGL可以减少轻度TBI后的神经病理变化,改善突触可塑性、空间学习和记忆。然而,药物抑制MAGL在TBI中展现神经保护效应的机制尚不清楚。
二、研究方法
研究方法主要包括准备KO动物、细胞培养、 建立反复轻度闭合性颅脑损伤模型、海马组织切片、电生理记录、WB等,主要关注单细胞分析过程。
Single-cell RNA-seq data analysis
The filtered unique molecular identifiers (UMI) feature-barcode matrices were produced byCellRanger Mkfatsq/Count Analysis (10xGenomics.com), and Seurat R package (v3) was usedfor subsequent analysis 9. For quality control, cells with mitochondrial content > 30% and with <400 or > 6000 genes per cell were removed; and genes with a count of 1 in at least 20 cells wereretained. LogNormalize”, a global-scaling normalization method, was used to normalize the databy a scale factor of 10000. Principal component analysis (PCA) was performed using the top 3000variable genes prior to clustering. To visualize profiles in two-dimensional space, t-distributedstochastic neighbor embedding (t-SNE) was performed with the top 20 principal componentsbased on the ElbowPlot. Clustering was performed using the FindClusters function (working onthe K-nearest neighbor graph model) in Seurat R package, and the resolution is 0.3. For identifyingthe cell type, ‘aqp4’, ‘gja1’, ‘slc1a2’ and ‘gpr37l1’ were used as specific cell markers forastrocytes, while ‘aif1’, ‘itgam’, ‘csf1r’, and ‘tmem119’ were used as specific cell markers formicroglia. These markers were used to assign cell-type annotations manually for each cell cluster.Differentially expressed genes (DEG) between Sham and TBI group were identified usingFindMarkers function of Seurat package in R, which works on the Wilcox method. Averaged log2(fold change) of gene expression, the percentage of cells expressing the genes in each group (pct.1and pct.2), p value and adjusted p value were generated. Min.pct = 0 and logfc. threshold = 0 wereused in finding DEGs. DEGs lists were produced by filtering all genes for log2 fold changes > 0.1and adjusted P < 0.05
- 数据生成:通过CellRanger Mkfatsq/Count Analysis进行,生成了经过筛选的UMI特征条形码矩阵。
- 质量控制:从数据中移除了线粒体含量大于30%以及每个细胞的基因数小于400或大于6000的细胞,以确保分析的质量。同时,保留了在至少20个细胞中至少有1次计数的基因。
- 标准化:使用“LogNormalize”方法对数据进行标准化,通过一个规模因子将数据标准化到10000的尺度上。
- 主成分分析(PCA):在进行聚类之前,对前3000个可变基因执行PCA。
- 可视化:使用t-distributed stochastic neighbor embedding(t-SNE)将数据在二维空间中可视化,基于Elbow Plot选择前20个主成分。
- 聚类:使用Seurat R包中的FindClusters函数进行聚类,基于K-nearest neighbor图模型,并且设置分辨率为0.3。
- 细胞类型鉴定:通过特定细胞标记物(如’aqp4’、’gja1’、’slc1a2’和’gpr37l1’用于星形胶质细胞,’aif1’、’itgam’、’csf1r’和’tmem119’用于小胶质细胞)来手动为每个细胞簇分配细胞类型注释。
- 差异表达基因(DEG)分析:使用Seurat包中的FindMarkers函数进行,使用Wilcox方法进行差异表达基因分析。生成了基因表达的平均log2(fold change)、每个组中表达该基因的细胞百分比(pct.1和pct.2)、p值和经过调整的p值。DEG列表通过筛选出log2折叠变化> 0.1和调整后的P < 0.05的所有基因来生成。
三、研究结果
1.MAGL条件敲除小鼠的产生与特性分析
前期研究表明,使用JZL184等药物来抑制MAGL可以缓解TBI引发的神经病理。为了确定是否与药物抑制类似,遗传删除MAGL是否可以减轻TBI引发的神经病理,以及MAGL灭活引起的神经保护作用是否与细胞类型有关,研究者使用了Mgll flox/flox小鼠,通过Supplementary Figs 1和2A中所示的策略生成了这些小鼠。然后,利用这些小鼠生成了特定细胞类型的MAGL敲除小鼠,包括tKO、nKO和aKO MAGL敲除小鼠系列。
值得注意的是,在这项研究中,没有生成小胶质细胞MAGL敲除小鼠,因为在小胶质细胞中MAGL对2-AG的降解作用不显著。早前研究已经证明,小胶质细胞中产生的2-AG数量在大脑中的总2-AG库中所占比例微不足道,而MAGL在小胶质细胞中的敲除并不会改变大脑中2-AG的含量,这表明MAGL在小胶质细胞中可能不起降解2-AG的重要作用。最近的研究也证实,小胶质细胞中的2-AG主要由ABHD12水解。
接下来,研究者通过体外免疫印迹验证了tKO、nKO和aKO小鼠中MAGL的选择性敲除。结果显示,从tKO和nKO小鼠培养的海马神经元中未检测到MAGL的表达,但在野生型和aKO小鼠的培养海马神经元中检测到了MAGL。类似地,从tKO和aKO小鼠培养的星形胶质细胞中未检测到MAGL的表达,但从野生型和nKO小鼠的培养星形胶质细胞中检测到了MAGL。这些结果表明,MAGL被条件性删除。此外,细胞类型特异性的MAGL敲除在体内也通过免疫印迹、定量聚合酶链反应(qPCR)和免疫染色等方法得到了进一步的确认。
2. 星形胶质细胞中的 MAGL 失活可减少反复轻度闭头损伤后的神经炎症
研究首先通过检测大脑中与炎症相关的基因(包括Vim和细胞因子Il1b、Il6和Tnfa)的mRNA表达来评估神经炎症。结果显示,在接受了三次冲击的野生型小鼠中,这些基因的表达显著增加,而对照组(野生型小鼠,未接受冲击)的表达较低。但是,在具有遗传敲除MAGL的小鼠中(tKO和aKO),TBI引发的这些炎症因子的表达显著降低,而在nKO小鼠中降低程度较小,这表明增强星形胶质细胞中的2-AG信号在解决TBI引发的神经炎症中起到了至关重要的作用。
免疫染色数据进一步支持了上述发现,显示在TBI后的30天内,具有遗传敲除MAGL的小鼠(tKO和aKO)中,Ib1a(小胶质细胞标记物)和GFAP(星形胶质细胞标记物)的免疫反应性显著降低。而在nKO小鼠中,这种降低程度较小,甚至可能没有。这些结果表明,通过药物或全局基因敲除MAGL,能够在TBI中产生抗炎症效应,这主要是通过限制星形胶质细胞中的2-AG代谢而非神经元中的2-AG代谢来实现的。强调了星形胶质细胞中2-AG信号的重要性,以解决TBI引发的神经炎症。
3.抑制星形胶质细胞中的 2-AG 代谢可增强对创伤性脑损伤引起的变化的恢复能力,减少炎症相关基因的表达
由于神经炎症在机械性创伤后引发次生脑损伤中起着关键作用,而星形胶质细胞和小胶质细胞是神经炎症的主要参与者,因此研究者使用了10x Genomics Chromium scRNA-seq技术来评估野生型、nKO和aKO小鼠中星形胶质细胞和小胶质细胞的基因表达情况,这些小鼠接受了三次mCHI。
在这项研究中,Aqp4、Gja1、Slc1a2和Gpr37l1被用作星形胶质细胞的特定细胞标记物,而Aif1、Itgam、Csf1r和Tmem119被用作小胶质细胞的特定细胞标记物。通过10x Genomics Chromium scRNA-seq技术,研究者评估了这些细胞类型的基因表达。
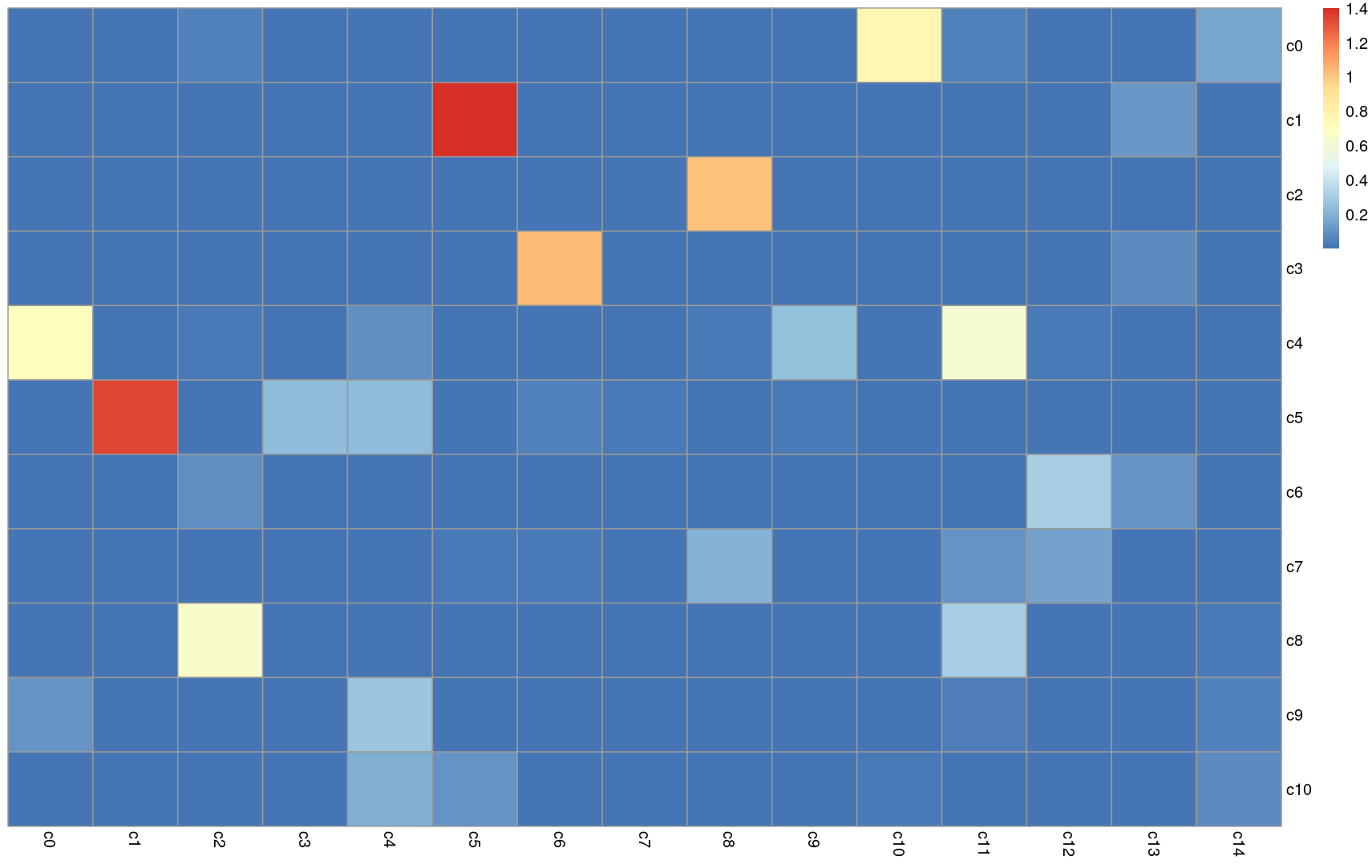
研究结果显示,TBI导致了野生型和nKO小鼠的星形胶质细胞和小胶质细胞中大量基因的上调或下调表达,但在aKO小鼠中的效应较小。尤其重要的是,在野生型和nKO小鼠中,TBI导致了与炎症有关的基因上调,与抗炎症反应或大脑稳态维持相关的基因下调(Ccl12, Ccl4, Ccl7, Ptgs2, Ccl3, Cx3cr1, P2ry12, and Cd86 )。而在aKO小鼠中,这些效应较小。
![图片[1]-文献阅读:增强星形胶质细胞内的内源性大麻素信号可促进创伤性脑损伤的恢复-吃了吃了](https://cdn.ineuro.net/cloudreve%2F2023%2F08%2F29%2Favaz5MdS_%E5%BE%AE%E4%BF%A1%E6%88%AA%E5%9B%BE_20230829141609.png)
此外,基因表达差异分析还显示,在野生型和nKO小鼠的星形胶质细胞和小胶质细胞中,更多参与免疫和炎症信号通路的基因上调,而在aKO小鼠中上调的基因较少。
单细胞测序数据表明,通过抑制星形胶质细胞中的2-AG代谢,可以使大脑更具抵抗TBI引发的神经炎症相关基因表达变化的能力。这些结果表明,星形胶质细胞中2-AG信号的调节在减轻TBI引发的神经炎症方面发挥了关键作用。
4.选择性失活星形胶质细胞中的 MAGL 可降低TBI诱发的神经病理变化
TDP-43和过度磷酸化tau(p-tau)的聚集是TBI引发的神经病理的标志。以前的研究已经表明,通过药物抑制MAGL可以显著降低TBI动物中TDP-43和p-tau的表达。为了确定遗传敲除MAGL是否也能防止TBI引发的TDP-43过度生成和p-tau,研究者在接受了三次mCHI冲击的野生型、tKO、nKO和aKO小鼠中,在第一次冲击后的30天内评估了TDP-43和p-tau-T181(p-tau)水平。他们发现,重复的mCHI显著提高了野生型小鼠的TDP-43和p-tau水平,但没有在tKO和aKO小鼠中观察到这种增加。令人惊讶的是,TBI后nKO小鼠的TDP-43和p-tau水平显著升高,与野生型小鼠类似。研究还评估了tau在额角叶的其他磷酸化位点(p-tau-Ser202、p-tau-Thr231、p-tau-Ser396和p-tau-Ser404)的水平,发现TBI导致了野生型和nKO小鼠中p-tau Ser202、Thr231、Ser396和Ser404的显著增加,但在tKO和aKO小鼠中未观察到这种增加。这些结果表明,星形胶质细胞中的2-AG降解在TBI引发的TDP-43过度生成和多个位点的tau磷酸化中起重要作用,通过抑制MAGL的星形胶质细胞中的2-AG代谢,可以预防TBI引发的神经病理变化。
脑弥漫性轴索损伤已被认为是TBI最常见和重要的病理特征之一。APP的表达在TBI后会增加,而APP不仅是淀粉样蛋白β的前体,还是TBI后弥漫性轴索损伤的重要标志。研究者评估了TBI引发的轴索损伤是否得到了遗传敲除MAGL的缓解。结果显示,在接受了三次冲击的野生型和nKO小鼠中,大脑皮质和海马中的APP显著升高,但在tKO和aKO小鼠中没有观察到这种增加。这些结果表明,限制星形胶质细胞中的2-AG降解可以预防TBI引发的轴索损伤。
神经退行性病变是TBI的重要神经病理特征之一。以前的研究已经表明,TBI后接受JZL184(一种强效MAGL抑制剂)治疗的动物中,退行性神经元的数量显著减少。为了确定MAGL的敲除是否也能减少TBI后的神经退行性病变,研究者评估了受到重复mCHI影响的小鼠大脑中Fluoro-JadeVR C(神经退行性标志物)阳性神经元的数量。他们发现,重复的mCHI显著增加了野生型小鼠在冲击后30天内皮质和海马中Fluoro-JadeVR C阳性神经元的数量(图4B)。预期地,MAGL敲除小鼠中的退行性神经元数量也显著减少。然而,与tKO或aKO小鼠相比,nKO小鼠中的退行性神经元减少幅度要小得多。这些数据表明,通过药物抑制或全局敲除MAGL,在TBI后减少的神经退行性主要是通过抑制星形胶质细胞中的2-AG代谢而产生的。
总之,研究发现通过限制星形胶质细胞中的2-AG降解,可以在多个方面减轻TBI引发的神经病理变化,包括减少TDP-43过度生成、减轻tau在多个位点的磷酸化、预防轴索损伤和降低神经退行性病变。这些结果突显了2-AG信号通路在TBI治疗中的重要性,尤其是其在星形胶质细胞中的作用。
需要注意的是,在这些研究结果中,tKO和aKO小鼠(星形胶质细胞中MAGL被敲除的小鼠)在多个方面表现出明显的神经保护作用,而nKO小鼠(神经元中MAGL被敲除的小鼠)的神经保护效应较小。这表明星形胶质细胞中的2-AG信号通路在TBI后的神经保护中起到关键作用。
5.星形胶质细胞中的 MAGL 失活可预防创伤性脑损伤引起的突触和认知功能退化
为了确定通过遗传敲除MAGL来抑制2-AG降解是否可以预防TBI引发的长期突触可塑性、学习和记忆受损,研究者使用电生理记录评估了海马Schaffer支撑纤维突触的长时程增强。这些测试是在第一次TBI冲击后的30天内进行的。他们发现,重复的mCHI显著损害了野生型小鼠的海马长时程增强(图5A和B)。然而,TBI引发的长时程突触可塑性损害在tKO和aKO小鼠中得以避免,但在nKO小鼠中未观察到这种情况。研究者还使用Morris水迷宫测试评估了空间学习和记忆。与野生型小鼠相比,TBI引发的空间学习和记忆缺陷在tKO和aKO小鼠中得以预防,但在nKO小鼠中未观察到这种情况(图5C和D以及补充图8)。出乎意料的是,sham-nKO小鼠显示出空间学习和记忆受损(图5C和D),这表明神经元中的2-AG正常降解对于正常的认知功能是必要的。研究者还注意到,在aKO小鼠中,TBI引发的学习和记忆受损完全消失,但在tKO小鼠中未观察到这种情况(图5C和D)。这可能是因为tKO小鼠中神经元MAGL的失活会加重Morris水迷宫测试的表现。研究数据提供了证据,通过在星形胶质细胞中失活MAGL来限制2-AG代谢可以在脑损伤后维持大脑功能的稳态。
![图片[2]-文献阅读:增强星形胶质细胞内的内源性大麻素信号可促进创伤性脑损伤的恢复-吃了吃了](https://cdn.ineuro.net/cloudreve%2F2023%2F08%2F29%2F9MZtJtaH_8-f5.png)
6.中断星形胶质细胞中的 2-AG 代谢可防止 TBI 导致的谷氨酸受体亚基表达减少
重复性mCHI会导致谷氨酸受体亚单位表达下调,这些亚单位是兴奋性突触传递和可塑性的关键组成部分,而MAGL的药物抑制可以防止TBI引发的这些亚单位的下调。研究人员预测,MAGL的敲除应该可以防止TBI引发的谷氨酸受体亚单位表达的恶化。TBI导致野生型小鼠在冲击后30天的海马中,AMPA受体亚单位(包括GluA1和GluA2)和NMDA受体亚单位(包括GluN1、GluN2A和GluN2B)的明显下调(图5E-G)。然而,在tKO和aKO小鼠中,TBI引发的这些亚单位的下调明显减轻,但在nKO小鼠中未观察到这种情况(图5E-G)。研究人员还观察到,与野生型小鼠相比,sham nKO小鼠中GluA1和GluA2的表达显著降低(图5F)。这可能是导致nKO小鼠的空间学习和记忆受损,如图5C和D所示。这些结果表明,通过抑制星形胶质细胞中的2-AG代谢,可以通过维持兴奋性谷氨酸突触的完整性来防止TBI引发的突触和认知下降。
7.星形胶质细胞中 MAGL 的表达升高
星形胶质细胞中的2-AG代谢促进了TBI引发的神经病理和突触以及认知下降。研究人员假设TBI可能通过提高星形胶质细胞中MAGL的表达来加速2-AG的降解,从而促进神经炎症反应和神经病理性变化。为了验证这一假设,研究人员评估了TBI后野生型小鼠中MAGL的表达。研究人员发现,在TBI后,大脑中的MAGL表达上升(附图9A)。由于用于免疫印迹分析的均质化脑组织样本包含了所有类型的细胞,因此研究人员想知道MAGL的表达增加是否主要是由于TBI后星形胶质细胞数量增加。为此,研究人员使用双重免疫染色来检测GFAP阳性星形胶质细胞中MAGL的表达,并观察到GFAP阳性星形胶质细胞中的MAGL表达显著上升(附图9B)。鉴于这些发现,研究人员在细胞类型特异性MAGL敲除小鼠中通过质谱分析评估了大脑中的2-AG。研究人员发现,在对照条件下,tKO小鼠的2-AG含量增加了7倍以上,nKO小鼠增加了5倍,而aKO小鼠增加了约2倍,这表明大脑中的大部分2-AG是由神经元中的MAGL代谢的(附图9C)。这些数据与先前的报告一致。然而,在每种基因型中,TBI后24小时检测到的大脑2-AG水平与sham组相比没有显著变化(附图9C)。这可能是由于在星形胶质细胞中产生的2-AG相对较少,对大脑中的总2-AG池的贡献较小。
8.MAGL 失活缓解神经病理学和认知能力下降是通过 CB1R 介导的
通过在星形胶质细胞中遗传性删除MAGL可以减轻TBI引发的神经病理学问题,并预防突触和认知功能的下降,这与之前的研究结果使用JZL184相似。然而,目前尚不清楚通过星形胶质细胞MAGL的失活在TBI中产生的有益效果是否是通过增强2-AG信号传导及其下游介质CB1R或CB2R介导的。为了确定CB1R是否介导MAGL失活产生的神经保护效应,CB1R敲除小鼠在每次冲击后30分钟和连续四天内每天一次(总共七次注射)腹腔注射JZL184(10mg/kg)或载体,如先前所述(附图2C)。虽然JZL184预防了野生型小鼠中TBI引发的神经病理学问题和认知功能障碍(图6A和B),与之前的观察相似,但我们发现在接受TBI的CB1R敲除小鼠中,JZL184未能避免TBI引发的空间学习和记忆障碍以及神经病理学变化,包括TDP-43、磷酸化tau和突触标记物PSD-95(图6C和D)。这些结果表明,MAGL失活产生的神经保护效应主要是通过增强2-AG信号传导,从而激活下游的CB1R介导的信号通路实现的。
9.星形胶质细胞中的 PPARγ 在创伤性脑损伤中介导 2-AG 产生的神经保护作用
目前尚未进行研究来解析在星形胶质细胞中MAGL失活产生的TBI有益效应的下游信号通路。以前的研究表明,2-AG信号诱导的抗炎效应是通过刺激PPARc的活性和表达来介导的,PPARc通过抑制NF-jB的活性来抑制炎症相关基因的表达,而NF-jB是调控炎症相关基因表达的重要转录因子。鉴于PPARc与NF-jB之间的相互作用在控制中枢神经系统的神经炎症中起着重要作用,研究人员假设PPARc在星形胶质细胞中作为2-AG-CB1R介导的神经保护效应的下游信号分子。为了测试这一假设,研究人员首先评估了2-AG是否增加了PPARc的活性,并确定该活性是否可以被CB1R和PPARc拮抗剂阻断。此外,研究人员还使用15d-PGJ2作为内源性PPARc激动剂进行了阳性对照。结果显示,2-AG显著提高了PPARc荧光素酶活性,而这种增加可以被rimonabant(一种有效且选择性的CB1R拮抗剂)或GW9662(一种PPARc拮抗剂)阻断。然而,15d-PGJ2诱导的PPARc荧光素酶活性不受rimonabant的影响,但可以被GW9662阻断。这些结果表明,2-AG通过CB1R介导增加了PPARc活性。接下来,研究人员确定了TBI是否导致了PPARc的下调以及NF-jB的磷酸化(p-NF-jB)的增加,以及这些效应是否可以通过增强2-AG信号传导通过药物抑制MAGL来撤销。结果显示,TBI导致了野生型小鼠海马中PPARc表达的减少和p-NF-jB的增加。然而,使用JZL184治疗后,这些变化减轻或减弱,这表明增强2-AG信号传导可以减轻TBI引发的PPARc下调,从而提高p-NF-jB的表达。与预期一样,这些JZL184对PPARc和p-NF-jB的影响在CB1KO小鼠中没有观察到。为了确认MAGL失活导致的TBI中PPARc和p-NF-jB的变化,研究人员在MAGL敲除小鼠中评估了PPARc和p-NF-jB。结果显示,重复的mCHI显著降低了野生型小鼠的海马中PPARc的表达,并增加了p-NF-jB的表达。然而,在tKO和aKO小鼠中,但不在nKO小鼠中,TBI引发的PPARc减少和NF-jB增加被减轻。这些结果表明,星形胶质细胞中的2-AG降解通过下调PPARc和上调p-NF-jB促进了TBI引发的神经病理学变化,提示增强星形胶质细胞中的2-AG信号传导,而不是神经元中的信号传导,可以预防这些TBI引发的变化。 如果星形胶质细胞中的PPARc是介导MAGL失活引起的TBI中星形胶质细胞2-AG信号产生的神经保护效应的重要下游信号分子,那么在aKO小鼠中静默PPARc的作用应该消除或减轻对脑外伤的保护作用。为了测试这一假设,研究人员使用AAV载体介导的基因沉默技术,在aKO小鼠中特异性静默星形胶质细胞中的PPARc。结果显示,在接受AAV5-GFAP-eGFP-m-PPARc-shRNA载体注射的aKO小鼠中,TBI后的TDP-43、p-tau或p-NF-jB之间没有显著差异,但在接受AAV-PPARc-shRNA载体注射的aKO小鼠中,TBI后TDP-43、p-tau和p-NF-jB显著增加。同样,在接受AAV控制载体的aKO小鼠中,TBI并没有显著降低PSD-95的表达。然而,将PPARc在星形胶质细胞中沉默后,TBI显著降低了PSD-95的表达。重要的是,通过静默星形胶质细胞中的PPARc,消除了aKO小鼠中TBI引发的空间学习和记忆障碍的减轻。这些结果表明,星形胶质细胞中的MAGL失活产生的TBI中的神经保护效应可能主要通过2-AG-CB1R-PPARc信号传导介导。 为了确认PPARc作为星形胶质细胞2-AG信号介导的TBI中神经保护效应的重要下游信号分子,研究人员使用AAV5-GFAP-h-PPARc-FLAG-WPRE载体在野生型小鼠的星形胶质细胞中过表达人类PPARc。结果显示,在接受AAV控制载体治疗的野生型小鼠中,TBI显著增加了TDP-43、p-tau和p-NF-jB,并降低了PSD-95的表达。然而,在过表达星形胶质细胞中PPARc的野生型小鼠中,TBI引发的神经病理学变化得到缓解,并且TBI不会显著降低这些小鼠的认知功能。这些数据提供了证据,表明PPARc充当了一个重要的下游信号分子。








暂无评论内容