摘要
研究人员利用高通量RNA测序(RNA-seq)技术,研究了脑膜对创伤性脑损伤(TBI)和衰老的转录反应,这一研究涵盖了亚急性和慢性的时间框架。研究人员首先使用单细胞RNA测序(scRNA-seq)探索了轻度TBI如何影响年轻小鼠受伤后一周脑膜中的细胞和转录景观。然后,研究人员使用批量RNA-seq,评估了年轻和老年小鼠在TBI后的长期不同结果。在scRNA-seq研究中,研究人员强调了主要脑膜细胞群体(包括巨噬细胞、成纤维细胞和适应性免疫细胞)在基因表达方面与损伤相关的变化。研究发现,TBI导致巨噬细胞中I型干扰素(IFN)特征基因的上调,以及成纤维细胞和适应性免疫细胞群体中与炎症相关基因的有控制的上调。由于尚不清楚的原因,即使是轻微的伤害,也可能导致老年人认知下降和灾难性的神经病理学变化。为了更好地理解年轻人和老年人在脑损伤后的不同结果,研究人员在TBI后1.5个月对年轻和老年脑膜进行了批量RNA-seq。值得注意的是,研究发现,仅衰老本身就诱导了脑膜中涉及B细胞抗体产生和I型IFN信号传导的基因上调。受伤后,年轻小鼠的脑膜转录组在很大程度上已恢复到受伤前的状态。相比之下,老年TBI小鼠仍然表现出免疫相关基因的上调和参与细胞外基质重塑的基因的下调。总体而言,这些发现展示了年轻和衰老过程中,脑膜对轻度头部创伤的动态转录反应。
原文:Bolte, Shapiro et al. eLife 2023;12:e81154. DOI: https://doi.org/10.7554/eLife.81154
Sequencing data have been deposited in GEO under accession code GSE206941. All code used for analysis is available at https://github.com/danielshapiro1/MeningealTransciptome (copy archived at swh:1:rev:d75b20d74f147524296630b9ec7a1c9c5a9f124f). All data generated or analyzed during this study are included in the manuscript and supporting file; Source Data files have been provided for all figures.
一、研究背景
每年,创伤性脑损伤(TBI)影响着数百万人,并可能导致严重的长期后果。虽然TBI影响所有年龄段的个体,但老年人相较于年轻人更容易遭受类似损伤的严重后果。这种与年龄相关的大脑损伤反应差异的原因尚未完全清楚。多项研究指出,TBI后免疫系统的长期激活可能导致一些负面后果。有趣的是,一些研究指出老年人的免疫反应有所不同,可能导致更严重的后果。然而,我们对老年人与年轻人在TBI后中枢神经系统(CNS)反应的差异性理解仍处于初级阶段。
最近的研究发现,脑膜——位于大脑实质和头骨之间的三层组织——是对TBI的早期反应者,也是TBI后CNS免疫反应的关键贡献者。在轻度TBI患者中,约50%的人可以在磁共振成像(MRI)中看到脑膜增强,尽管没有明显的实质性损伤。这种增强在受伤后几分钟内就会发生。此外,许多轻度TBI患者仍显示出对比剂渗漏到蛛网膜下腔,表明血脑屏障受损。大多数患者在受伤后19天内脑膜增强消退,但约15%的患者在受伤后三个月仍有持续增强,表明一些患者在轻度TBI后脑膜修复不完全。这些延长的脑膜增强可能代表着该区域内持续的炎症,但驱动这种炎症的不同细胞和分子成分尚未被充分研究。
脑膜对脑损伤的反应可以分为几个阶段:急性、亚急性和慢性。急性阶段的初步研究显示,轻度TBI后的脑膜反应包括血管渗漏和活性氧释放导致的快速脑膜细胞死亡,这在受伤后的最初几小时内导致了次要实质性损伤。急性脑膜反应已被研究,但对于脑损伤如何更长期地塑造脑膜环境,以及这种反应是否受到衰老的影响,目前了解甚少。此外,尚不清楚老年人脑损伤后的慢性脑膜变化是否会导致神经退行性过程。
除了承载淋巴管,将分子和细胞排入周围淋巴结外,脑膜还包含一整套先天和适应性免疫细胞,它们与神经元和胶质细胞不断交流。在稳态下,脑膜免疫细胞的细胞因子信号对于塑造认知至关重要。例如,IFN-γ对于维持社交行为网络很重要,而脑膜T细胞产生的IL-4已被证明影响学习和记忆。最近的研究还表明,脑膜中γδ T细胞分泌的IL-17a可以影响焦虑样行为和记忆。特别相关的是,最近的工作表明,脑膜T细胞CCR7表达的与年龄相关的下降可能导致认知障碍、大脑炎症和神经退行性疾病。此外,蛛网膜下腔中脑脊液(CSF)中的免疫细胞也能产生信号分子,并与大脑衍生的产物和抗原相互作用。尽管越来越多的证据表明脑膜细胞可以影响神经生物学的各个方面,但我们仍缺乏对脑膜如何响应广泛与神经疾病相关的过程(如脑损伤和衰老)的完整了解。同样,关于衰老如何影响脑膜生物学,无论是在稳态条件下还是在TBI反应中,也知之甚少。
在这里,我们研究了脑膜转录环境在TBI和衰老后如何改变,利用了高通量测序技术,即单细胞RNA测序(scRNA-seq)和批量RNA测序(bulk RNA-seq)。我们关注了脑损伤后亚急性(TBI后一周)和慢性(TBI后1.5个月)时间点,以更好地了解脑膜中的细胞组成和基因表达谱随时间和年龄的变化。我们发现,TBI后一周,脑膜的异质细胞组成发生了变化,巨噬细胞和成纤维细胞的频率增加。此外,我们还发现,衰老中的脑膜转录环境发生了显著改变,包括参与抗体产生和I型干扰素(IFN)信号传导的基因广泛上调。当检查TBI后1.5个月老年小鼠与年轻小鼠相比的差异表达基因时,我们发现有重要的胞外基质重塑和胶原蛋白产生的基因下调,以及整体上免疫系统相关基因的激活。这种免疫系统的长期激活是老年TBI小鼠所特有的,因为年轻小鼠在受伤后1.5个月几乎没有改变脑膜转录组。为了识别在衰老中可能在亚急性受伤后持续存在的慢性转录变化,我们识别了批量RNA-seq和scRNA-seq数据集之间共有的差异表达基因。我们发现,在年轻小鼠受伤后一周最初上调的对于维持免疫反应至关重要的基因,在慢性环境下TBI后1.5个月仍然上调。在受伤后一周下调的对于结缔组织维护和伤口愈合重要的基因,在受伤后1.5个月仍然下调。这些发现有助于揭示衰老后脑损伤所见的慢性失调转录反应模式。总体而言,这项研究强调了脑膜转录组对TBI和衰老的动态反应,并阐明了年轻人和老年人在脑损伤反应方面的一些差异。
二、研究结果
2.1 轻度颅脑损伤引发脑膜细胞组成的变化。
为深入了解颅脑损伤如何影响脑膜生物学,我们对小鼠进行了轻度闭颅损伤,并在伤后一周进行了脑膜单细胞RNA测序(图1a)。在这个轻度颅脑损伤模型中,小鼠使用立体定向电磁撞击器受到一次性击打右侧颞叶和额叶(图1—附图1a;Bolte等,2020年)。值得注意的是,我们先前已经证明在这个模型中的头部损伤不会导致平衡、运动协调、反射和警觉性的明显改变(Bolte等,2020年)。与这个轻度颅脑损伤模型的性质一致,我们在头部创伤后24小时也没有观察到CD31血管标记物染色的明显差异(图1—附图1b和c)。此外,我们只在颅脑损伤后24小时在脑膜中检测到轻微的胶质增生(Iba1和GFAP染色)(图1—附图1d,e和f)以及MHCII +染色(图1—附图1g,h和i)。在本文的所有测序研究中,我们策略性地选择仅分离背侧脑膜组织,因为这个区域的脑膜不包括直接损伤部位的组织。因此,从这些研究产生的测序数据应更好地反映由局部损伤部位引起的全局脑膜变化,而不是直接损伤部位的组织损伤和响应。对Sham和TBI脑膜的联合聚类显示了21个独特的细胞群,包括内皮细胞、成纤维细胞、施万细胞和脑脊液脑室上皮细胞(图1b和c,表1)。此外,脑膜包含完整的免疫细胞组成,包括巨噬细胞、B细胞、T细胞、NK细胞、树突状细胞、浆细胞样树突状细胞和中性粒细胞(图1b和c,表1)。其他细胞群的定义较差,包括表达与凝血有关基因和增殖细胞的细胞(图1b和c,表1)。在按Sham和TBI处理分开时,这21个细胞群在两组中仍然存在(图1d,表1),但频率有所不同(图1e)。在脑损伤后,一组巨噬细胞的频率较高,我们将其标记为“活化巨噬细胞1”,因为它们表现出与补体相关基因的高表达(图1c和e)。此外,脑外伤后成纤维细胞的频率显著增加(图1e)。虽然其他细胞类型的频率有所减少,即B细胞群,但尚不清楚这是相对于其他亚群的扩张还是实际数量减少(图1e)。为确保样品制备的短暂消化和处理步骤没有导致TBI和Sham样本中应激相关基因的显著上调,我们检查了一组已知在组织处理和应激条件下上调的基因(Haimon等,2018年; Marsh等,2020年; Van Hove等,2019年; 图1—附图2)。极少数测序的细胞表达了这些基因,并且在TBI或Sham实验组之间没有实质性差异,表明处理对基因表达的贡献较小,并且在实验组之间有相似的影响(图1—附图2)。总体而言,这些数据突显了脑膜组织的异质性,并且证明了巨噬细胞和成纤维细胞群的频率在TBI后1周增加。
![图片[1]-文献阅读:脑膜对创伤性脑损伤和衰老的转录反应-吃了吃了](https://cdn.ineuro.net/cloudreve%2F2024%2F01%2F16%2FetMwv8nB_1.png)
![图片[2]-文献阅读:脑膜对创伤性脑损伤和衰老的转录反应-吃了吃了](https://cdn.ineuro.net/cloudreve%2F2024%2F01%2F16%2FqSDuzdKL_1-s.webp)
![图片[3]-文献阅读:脑膜对创伤性脑损伤和衰老的转录反应-吃了吃了](https://cdn.ineuro.net/cloudreve%2F2024%2F01%2F16%2FzFM1XqxS_1-s2.webp)
2.2 轻度脑外伤对脑膜巨噬细胞转录组的影响
鉴于我们的数据显示伤后脑膜巨噬细胞群体明显扩张(图1e),以及新兴数据表明这些细胞在创伤性脑损伤(TBI)病理发生中扮演重要角色(Russo等,2018年;Roth等,2014年),我们决定首先关注脑膜巨噬细胞对头部创伤的反应。对“激活的巨噬细胞”群体(激活的巨噬细胞1&2)的差异基因表达分析显示,在头部受伤后,有321个上调基因和369个下调基因,使用的错误发现率<0.1(图2a)。当我们对这些群体中显著上调的基因进行网络分析时,我们发现与免疫系统激活相关的途径富集(图2b)。激活群体中上调的基因包括那些对细胞因子分泌、免疫细胞分化、运动性和趋化性重要的基因(图2b)。此外,对头部创伤的反应中最高富集的基因本体(GO)生物过程被发现与免疫系统激活和应激反应相关(图2c)。我们还注意到,对免疫相关GO术语贡献最显著的上调基因中,有些对I型干扰素(IFN)反应很重要,包括Ifnar1、Ifi203、Irf2bp2和Irf5等(图2d)。接下来,我们通过qPCR检查了伤后一周整个脑膜样本中I型IFN基因表达。我们观察到包括Ifnar1、Irf5、Ifnb1和Ifi203在内的基因表达升高,凸显了TBI后强烈的I型IFN基因特征,这可能是由脑膜巨噬细胞驱动的(图2e–h)。有趣的是,最近的研究表明,大脑实质中I型IFN信号的升高是TBI病理发生中不良结果的驱动因素(Karve等,2016年;Barrett等,2020年)。
综合这些发现表明,脑膜巨噬细胞在脑损伤后一周上调炎症相关基因,并可能有助于TBI后观察到的I型IFN特征。此前的发现还表明,有几种脑膜巨噬细胞亚型对TBI有反应(Russo等,2018年)。因此,我们决定更仔细地研究原始巨噬细胞簇内的亚群体。我们重新聚集了来自假手术和TBI脑膜的三个巨噬细胞群体(激活的巨噬细胞1&2,和巨噬细胞3),得到了六种不同的脑膜巨噬细胞簇(图2i)。最大的巨噬细胞群体表达了高水平的铁蛋白(“铁蛋白表达”)(图2i)。在“铁蛋白表达”的巨噬细胞中,两个最重要的簇定义基因是铁蛋白轻链(Ftl1)和铁蛋白重链(Fth1)(图2i)。还有两个额外的群体,被称为“抗炎”和“解决阶段”巨噬细胞,似乎是另类激活的抗炎巨噬细胞,可能与伤后的愈合反应有关。在“抗炎”巨噬细胞簇中最重要的簇定义基因是Mrc1(也称为CD206),已知存在于在TBI后参与愈合反应的巨噬细胞上(Russo等,2018年)。在“抗炎”巨噬细胞群体中其他高度显著的亚簇定义基因包括Stab1、Nrros和Dab2,这些基因已知表达在愈合巨噬细胞上,并且对抑制活性氧物质和限制I型IFN反应很重要(Park等,2009年;Noubade等,2014年;Hung等,2016年;图2—图表补充1a)。 “解决阶段”巨噬细胞既不属于M1经典激活也不属于M2另类激活巨噬细胞类别,被认为在炎症事件后扮演调节作用(Stables等,2011年)。它们倾向于富集抗原呈递基因、趋化因子基因和与增殖相关的基因(Stables等,2011年)。事实上,“解决阶段”巨噬细胞簇的特征是它们表达与抗原呈递相关的基因(H2-Eb1、H2-Ab1、H2-Aa、Cd74、Ctss)以及抗炎基因,如Lair1,一种抑制性受体,可防止细胞因子生产过度激活(Meyaard等,1997年;图2—图表补充1b)。与这些“抗炎”和“解决阶段”簇相比,最后两个巨噬细胞群体展示了更常与炎症性巨噬细胞相关的基因特征(图2i)。”炎症1″巨噬细胞簇的定义是其差异性表达Ccr2和诸如Alcam和Lgals3等粘附分子(图2—图表补充1c)。第二个炎症性巨噬细胞亚群“炎症2”则通过其表达对趋化性重要的基因定义,包括Ccr7、Ccl22和Ccl5(Kwiecień等,2019年;Martinez和Gordon,2014年;图2—图表补充1d)。
为了确定伤害如何影响这些不同的脑膜巨噬细胞群体,我们将细胞分为假手术组和TBI组,并检查它们的频率(图2j和k)。有趣的是,在TBI组中,“抗炎”和“解决阶段”的巨噬细胞相对增加,表明在伤后一周,脑膜巨噬细胞的反应似乎转向伤口愈合和炎症解决(图2j和k)。伤后,“铁蛋白表达”的巨噬细胞也出现了相对减少(图2j和k)。总体而言,这些发现表明,尽管巨噬细胞在TBI后共同上调了对炎症必需的基因,但“解决阶段”和“抗炎”巨噬细胞的频率也增加,可能在伤口愈合过程中发挥作用。
![图片[4]-文献阅读:脑膜对创伤性脑损伤和衰老的转录反应-吃了吃了](https://cdn.ineuro.net/cloudreve%2F2024%2F01%2F16%2FzSJx7QdM_2.png)
![图片[5]-文献阅读:脑膜对创伤性脑损伤和衰老的转录反应-吃了吃了](https://cdn.ineuro.net/cloudreve%2F2024%2F01%2F16%2FA995e2Pt_2-s1.webp)
2.3 轻度TBI诱导脑膜成纤维细胞中与神经疾病相关基因的上调
接下来,我们想进一步研究“成纤维细胞”群体,因为在单细胞数据集中显示,伤后1周该群体有所扩张(图1d和e)。头部受伤后,“成纤维细胞”群体展现出368个激活基因和320个抑制基因(图3a)。伤后激活基因中有几种模式,包括对胶原蛋白生产和细胞外基质重塑重要的基因(如Nisch、Ppib、Pmepa1、Ddr2)和对细胞运动性和生长至关重要的基因(如Ptprs、Pfn1、Cd302、Tpm3)(图3b)。为了验证这些测序发现,我们利用免疫组织化学染色方法对成纤维细胞产生的胶原蛋白进行了染色,这在脑膜整体装片中进行。与测序结果一致,我们观察到在TBI后1周胶原蛋白密度显著增加(图3c、d和e)。此外,我们还有兴趣确定成纤维细胞群体是否对TBI后的炎症反应有所贡献。在TBI后成纤维细胞中识别出的显著上调基因中,许多与免疫系统激活和细胞因子信号传导的组分相关(图3f)。
为了探索轻度头部创伤后成纤维细胞最受影响的细胞和疾病途径,我们鉴定了与TBI后与假手术组相比在成纤维细胞群体中差异性上调的基因富集的
KEGG术语。有趣的是,与神经退行性疾病相关的疾病途径,包括帕金森病、阿尔茨海默病、肌萎缩侧索硬化症和朊病毒病,是TBI后在成纤维细胞中一些最高上调的途径(图3g)。许多与氧化磷酸化KEGG术语有贡献的相同术语也有助于各种疾病相关的KEGG术语,表明成纤维细胞的代谢状态变化可能是疾病相关过程的基础。
鉴于成纤维细胞存在于所有三层脑膜中(DeSisto等,2020年),我们决定调查成纤维细胞所在的层次,以及哪一层可能对TBI后成纤维细胞的增加负责。为此,我们检查了通常用于识别成纤维细胞可能居住的脑膜不同层次的分子表达(DeSisto等,2020年;Doro等,2019年;Cooper等,2012年;Zarbalis等,2007年;Kalamarides等,2011年;Siegenthaler等,2009年;Caglayan等,2014年)。更具体地说,近期研究表明,硬膜成纤维细胞可以使用Alpl和Foxc2标记物来识别(Doro等,2019年;Cooper等,2012年;Zarbalis等,2007年),而Ptgds和Ald1a2是蛛网膜成纤维细胞的独特标记物(Kalamarides等,2011年;Siegenthaler等,2009年),Col18a1则特异于脑膜成纤维细胞(DeSisto等,2020年;Caglayan等,2014年)。不出所料,我们发现脑膜中的大多数成纤维细胞来自硬膜,这是脑膜中最厚的层,也是这些研究中所使用的解剖方法所针对的层次(Alves de Lima等,2020b;Rua和McGavern,2018年)。如预期,少量的脑膜或蛛网膜居住成纤维细胞出现(图3h)。当我们观察TBI前后硬膜成纤维细胞基因的表达水平时,我们发现一些标记物(例如Foxc2,Fxyd5)在受伤后显著上调,而其他硬膜标记物虽然没有在显著更高水平上表达,但显然由更高比例的总细胞表达(例如Alpl,Mgp)(图3i)。这表明在脑损伤后一周,硬膜部位可能经历了成纤维细胞频率的增加,这与TBI后一周在脑膜中看到的胶原蛋白密度增加也是一致的(图3c,d和e)。总的来说,我们观察到脑膜成纤维细胞群体对TBI有高度的响应性,它们上调了富含疾病相关途径、免疫系统激活和伤口愈合反应的基因。
![图片[6]-文献阅读:脑膜对创伤性脑损伤和衰老的转录反应-吃了吃了](https://cdn.ineuro.net/cloudreve%2F2024%2F01%2F16%2Fc1lURvXV_3.png)
![图片[7]-文献阅读:脑膜对创伤性脑损伤和衰老的转录反应-吃了吃了](https://cdn.ineuro.net/cloudreve%2F2024%2F01%2F16%2FNV7AauM0_3-s1.webp)
2.4 轻度TBI对脑膜淋巴细胞的转录调节
由于我们观察到TBI后部分免疫细胞群体的频率变化(图1d和e),我们有兴趣确定在头部受伤后脑膜T细胞和B细胞中哪些基因表现出差异性表达,特别是考虑到近期的报告已经确定了脑膜淋巴细胞在调节神经生物学、行为和中枢神经系统疾病的多个方面的重要作用(Alves de Lima等人,2020a;Filiano等人,2016;Derecki等人,2010;Ribeiro等人,2019;Gate等人,2020)。我们分别结合了两个T细胞群体(“激活的T细胞”和“CD3+ T细胞”)和B细胞群体(“B细胞1”、“B细胞2”和“未成熟/分化B细胞”)来评估差异性基因表达。总体而言,在T细胞群体中,有151个基因在受伤后上调,286个下调;在B细胞群体中,有102个基因在受伤后上调,158个下调;在树突状细胞群体中,有183个基因在受伤后上调,149个下调(图4a)。一些较小的群体,如自然杀伤细胞、中性粒细胞和浆细胞样树突细胞,由于每个群体中细胞数量少,所以显示出很少或没有差异性调节基因(图4a)。
接下来,我们有兴趣确定哪些不同的T细胞和B细胞亚群存在于脑膜中,因此我们对这两个群体中的细胞进行了重新聚类(图4b和c)。我们发现在T细胞亚群中,明显存在一个CD8+T细胞群体和两个T辅助细胞群体:Th2细胞和Th17细胞(图4b)。Th2细胞亚群表达了高度显著的簇定义标记物,包括Il1rl1和Gata3,这些是Th2亚群的特征(Tibbitt等,2019年;图4b,图4—图表补充1a)。另一方面,Th17亚群表达了特征性标记物,如Il23r、Il17re和Rorc(Hu等,2017年;图4b,图4—图表补充1b)。第四个T细胞亚群看起来由NKT细胞和NK细胞组成,因为这个群体高度表达常见的NK标记物,包括Klrb1c、Ncr1、Klrd1和Klrk1,其中一些细胞还表达CD3共受体的组分(Cd3d、Cd3e和Cd3g)(图4b,图4—图表补充1c)。最后一个群体可能代表正在死亡的T细胞,基于它们对线粒体基因和Malat1的高度表达(图4b)。
对B细胞群体的重新聚类揭示了五个亚群(图4c)。其中一个亚群似乎由成熟B细胞组成,因为它高度表达B细胞成熟标记物Cd37和B细胞受体组分(Cd79a和Cd79b)(图4c;de Winde等,2016)。第二个被称为“激活B细胞”的簇,其特征是显著表达与HLA相关的基因,包括H2-Aa、H2-Eb1和H2-Ab1,以及与生存相关的基因,包括Gimap3、Gimap4和Gimap6。这些激活的B细胞还高度表达对粘附重要的基因,包括编码L-选择素的Sell,是成熟B细胞的标记(Lee等,2020年;图4c,图4—图表补充2a)。第三个簇看起来是基于它们对Rag1和Rag2的高度表达的分化中或未成熟B细胞(图4c,图4—图表补充2b)。第四个被称为“增殖细胞”的簇表达了高水平的Myc和Ccnd2等其他细胞周期相关基因(图4c,图4—图表补充2c)。最后一个群体可能代表正在死亡的B细胞,因为它们对Malat1的高度表达(图4c)。
为了确定脑膜内T细胞和B细胞成熟轨迹,我们使用Monocle3进行了伪时间分析(Trapnell等,2014)。T细胞群体在其分化状态中没有显示出强烈的轨迹,这是预期的,因为我们识别的群体(Th2、Th17、CD8+ T细胞)在T细胞成熟过程中都相对较先进(图4d)。然而,当我们检查B细胞的伪时间轨迹时,我们观察到了一个确认我们最初簇分配的路径(图4e)。我们观察到,在分化轨迹最早的B细胞,如伪时间尺度上的最低值所示的“未成熟B细胞”和“增殖细胞”群体,而可能产生抗体的“激活B细胞”和“成熟B细胞”在分化轨迹上最远(图4e)。
接下来,我们有兴趣更仔细地观察T细胞和B细胞群体中显著上调的一些基因,以确定这些适应性免疫群体在受伤后如何受到影响。T细胞群体上调了许多对生存重要的基因(如Gimap1、Gimap6)、激活基因(如Arrb2、Ppia、Cd48)、细胞因子信号传导基因(如Mif、Il2rg)以及抗原识别基因(如Cd247),所有这些都促成了炎症反应基因表达的总体增加(图4f)。同时,T细胞还上调了多种已知涉及抑制免疫反应的基因,如Socs1(细胞因子信号抑制剂-1)和Cd52(图4f;Liau等,2018;Toh等,2013)。
调查受伤后在B细胞群体中上调的基因,我们发现许多这些基因属于“B细胞成熟”类别,包括Cd83、Ube2d3和Doc3(图4g)。其他上调的基因包括那些对B细胞激活和信号传导重要的基因(如Blnk、Cd19)、抗原呈递(如Cd79b、H2-D1)和炎症相关基因(如Ppia、Hmgb1)(图4g)。这些基因的上调表明TBI促使脑膜隔室中B细胞群体的激活和成熟。总体而言,这些数据表明,在头部创伤后,T细胞和B细胞都会上调涉及适应性免疫反应激活的基因。这种上调似乎是受控的,因为多个调节基因也同时被激活。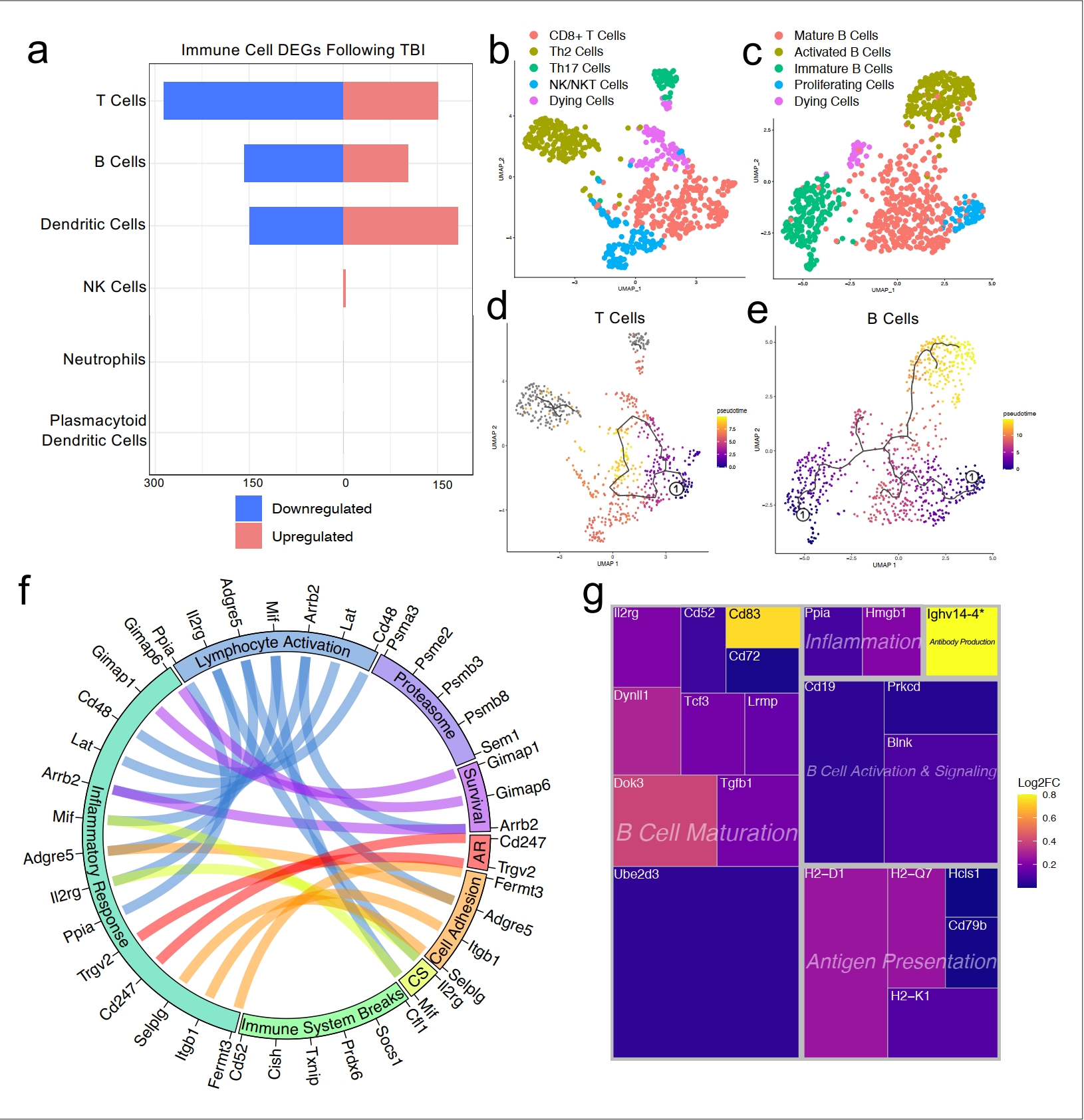
![图片[8]-文献阅读:脑膜对创伤性脑损伤和衰老的转录反应-吃了吃了](https://cdn.ineuro.net/cloudreve%2F2024%2F01%2F16%2FlxNa1aJD_4-s1.webp)
![图片[9]-文献阅读:脑膜对创伤性脑损伤和衰老的转录反应-吃了吃了](https://cdn.ineuro.net/cloudreve%2F2024%2F01%2F16%2FEtZDbyp9_4-s2.webp)
2.5 预测的配体-靶标相互作用凸显了TBI后促生长和受控制的促炎症脑膜环境
细胞与细胞之间的相互作用可能部分决定了TBI后观察到的基因表达动态。我们使用Nichenet来探索细胞间通讯如何影响伤后的转录环境。Nichenet是一个工具,它整合了相互作用细胞的基因表达数据,以推断发送细胞配体对接收细胞表达的影响(Browaeys等,2020年)。由于巨噬细胞和成纤维细胞群体在TBI后都表现出显著的转录改变,我们将分析重点放在这些大型群体的信号如何影响其他脑膜细胞(图1e)。
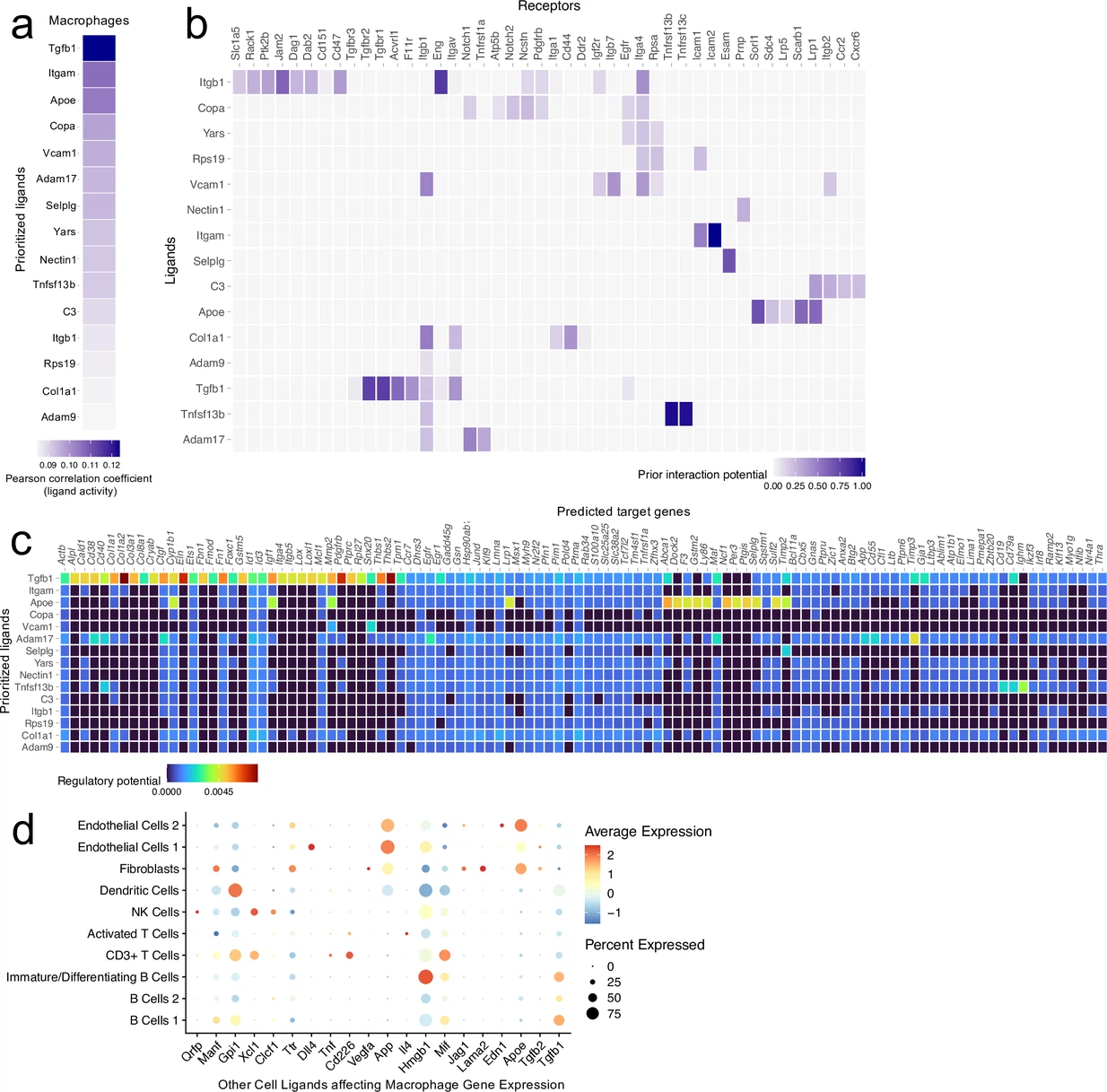
我们首先检查了巨噬细胞群体如何可能影响scRNA-seq数据集中其他主要细胞群体(T细胞、B细胞、树突状细胞、NK细胞、成纤维细胞和内皮细胞)的基因表达模式,通过推断的配体-靶标相互作用。在所有巨噬细胞配体中,Tgfb1最能预测其他细胞群体中所见的基因表达模式,表明观察到的转录动态反映了细胞生长、分化和巨噬细胞替代性激活的环境(图2—图表补充2a和b;Gong等,2012年)。此外,其他高预测的巨噬细胞配体包括Itgam、Apoe、Vcam1、Selplg、Nectin1和Itgb1,在细胞粘附和吞噬作用方面发挥关键作用,这两者都是激发炎症反应所必需的(图2—图表补充2a和b;Grainger等,2004年)。其他具有促炎特性的顶级配体包括Adam17,它参与细胞表面TNF的处理,Tnfsf13b,它促进B细胞的激活和增殖,以及C3,它是补体级联的一部分(Black等,1997年)。
我们观察到与预测的配体对靶细胞影响一致的基因表达变化和细胞表型。例如,Tgfb1信号被预测将激活多个影响胶原蛋白生产的基因,包括Col1a1、Col1a2和Col3a1(图2—图表补充2c),与我们发现的TBI后胶原蛋白生产增加相一致(图3c–e)。其他促炎配体如Adam17和Tnfsf13b的预测靶基因包括B细胞反应基因(Cd19、Cd79a和Ighm)以及与免疫细胞激活和抗原呈递相关的基因(Cd38和Cd40)(图2—图表补充2c)。最后,当我们检查来自脑膜中其他细胞的配体如何影响巨噬细胞的基因特征时,我们看到来自多个细胞群体(内皮细胞、树突状细胞、T细胞和B细胞)的配体可能负责塑造这一特征(图2—图表补充2d)。鉴于单核细胞和巨噬细胞可能与所有脑膜细胞群体互动,并在塑造TBI后观察到的整体基因表达特征中发挥非常重要的作用,这并不令人意外。总的来说,巨噬细胞群体与TBI后其他主要脑膜细胞群体之间预测的配体-靶标相互作用展示了一种增殖的、促炎的状态。
接下来,我们研究了脑膜成纤维细胞群体可能如何通过配体-靶标相互作用影响局部基因表达。与巨噬细胞配体一样,我们发现成纤维细胞中的顶级配体信号通路对细胞生长和分化至关重要。更具体地说,许多顶级配体对促进血管生成(如Vegfa、Cxcl12、Pgf)、生长和炎症(如Apoe、Csf1、Cxcl12、Tgfb3)以及细胞外基质发育和伤口愈合(如Col4a1、Hspg2、Nov)至关重要(图3—图表补充1a和b;Solé-Boldo等,2020;Buechler等,2021;Lin等,2005)。有趣的是,我们在顶级预测配体中发现了抗炎途径,包括Anxa1,它以其对粘附和迁移的抑制作用而闻名,以及Serping1,它负责C1抑制剂的产生(图3—图表补充1a和b;Gavins和Hickey,2012)。顶级配体Apoe的预测靶基因包括补体级联基因,如C1qb和C1qc,这两者在受伤后的脑膜巨噬细胞群体中都有上调。其他配体,如Csf1,也可能通过激活诸如Cd14和Cd68之类的基因来增强免疫反应,这些基因对炎症中的巨噬细胞/单核细胞反应至关重要(图3—图表补充1c;Buechler等,2021)。其他配体,如Vegfa,可能激活内皮细胞,从而上调对细胞生长和分裂重要的基因,包括Fos和Id1(图3—图表补充1c)。在进行逆向分析时,我们发现内皮细胞和巨噬细胞对成纤维细胞的转录组产生了强烈影响,这表现在细胞群体中有大量显著影响性配体的高表达(图3—附录1d)。总的来说,脑膜成纤维细胞可能在颅脑损伤后影响基因表达特征,以促进促生长和血管生成信号级联,同时平衡地上调免疫系统。这些与巨噬细胞一起预测的配体-靶标相互作用突显了年轻小鼠对损伤的高度复杂但协调和受控响应。
2.6 衰老和轻度脑外伤对脑膜转录组的显著影响
在年轻小鼠中观察到的脑损伤引起的脑膜转录和细胞景观的显著变化后,我们接下来有兴趣调查这些变化是否在老年人中保持不变或发生改变。先前曾有人提出,头部创伤后大脑无法有效解决炎症反应,这导致老年人中常见的疾病进程加重(Chou et al., 2018; Witcher et al., 2021; Witcher et al., 2018)。因此,我们特别有兴趣探索年轻和老年小鼠之间在TBI后脑膜免疫反应解决方面的潜在差异。为此,我们在年轻小鼠(10周龄)和老年小鼠(20个月龄)中,均在TBI或Sham处理后1.5个月进行了脑膜组织的批量RNA测序,因为我们预测年轻小鼠中的脑膜损伤将在TBI后1.5个月大部分得到解决(图5a)。主成分分析(PCA)显示年龄是差异基因表达的主要驱动因素,因为年轻组和老年组聚类最远(图5b)。然而,尽管年轻小鼠接受Sham或TBI的组聚集在PCA图中,老年Sham和TBI小鼠的组聚类更分散,表明与年轻小鼠相比,老年小鼠的基因表达受TBI的影响可能更持久(图5b)。实际上,当我们观察了所有四个实验组之间的差异表达基因的数量时,我们发现年轻Sham与年轻TBI之间仅有22个差异表达基因,而老年Sham与老年TBI之间有364个差异表达基因(图5c和d)。有趣的是,在比较年轻Sham小鼠与老年Sham小鼠时,发现了1772个差异表达基因,而在比较年轻TBI小鼠与老年TBI小鼠时,发现了2936个差异调控基因(图5c和d)。此外,我们还查看了哪些基因在比较组之间共享,以确定老年TBI中的TBI特征是否独特或主要与未受伤的老年小鼠共享。有趣的是,有917个下调基因和639个上调基因是年轻TBI与老年TBI之间独有的,与任何其他比较,包括年轻Sham与老年Sham的比较都不共享。有595个下调基因和592个上调基因在这两个比较之间共享,这表明尽管部分在年轻TBI与老年TBI组中看到的转录变化可能归因于衰老,但在受伤老年小鼠中有大量受影响的基因是在外伤情况下在老年小鼠中独特识别的。总的来说,这表明老化深刻影响了脑膜基因表达,并且老年人在经历轻度头部创伤后基因表达发生了更大的变化。此外,虽然年轻小鼠在TBI后1.5个月几乎没有基因表达变化,但老年小鼠在更长的时间内经历了更多的基因表达变化,这表明老年人在TBI后的恢复可能会受到延迟。
由于老化本身导致了明显不同的基因表达模式,我们决定在批量RNA-seq数据集中更仔细地研究这些差异。在检查老年Sham小鼠与年轻Sham小鼠相比前20个最显著上调和下调的基因时,我们注意到与B细胞抗体产生相关的基因明显上调(图6a)。事实上,前20个上调基因中有一半属于这一类别(图6a)。当我们检查了年轻Sham小鼠与老年Sham小鼠比较中显著激活的基因所富集的前20个GO生物过程时,我们发现免疫和防御反应位居其中(图6b),表明老年脑膜内的细胞已经在稳态条件下显著上调了它们的免疫反应。由于与抗体相关基因的显著上调非常明显,并且最近的研究报告称,随着年龄的增长,IgA分泌浆细胞增加(Fitzpatrick et al., 2020),我们在批量RNA-seq数据集中更仔细地检查了其中一些基因(图6c)。我们发现与免疫球蛋白重链(Ighm、Ighg2b、Igha)、轻链(Igkc)以及IgA或IgM抗体的组分相关的基因显著上调(图6c)。
因此,作为第二种验证方法,我们对整个硬膜脑膜进行了流式细胞术,以评估B220+和CD19+细胞在总CD45+细胞中的数量和频率(图6—图表补充1a)。与年轻的硬膜脑膜相比,老年硬膜脑膜的细胞总数较少(图6—图表补充1b)。在检查B220+、CD19+和B220+CD19+细胞总数时,我们在老年小鼠中没有看到显著差异(图6—图表补充1c)。虽然不显著,但与年轻对照组相比,老年硬膜脑膜中B220+、CD19+和B220+CD19+细胞的整体频率有所下降(图6—图表补充1d)。总的来说,我们没有在老年硬膜中看到B细胞数量的增加,这表明在老龄化过程中观察到的与抗体相关的基因表达的增加可能反映了脑膜中B细胞功能的变化,而不是更多B细胞的招募。我们的数据与其他已发表研究结果的差异可能反映了由于老年小鼠脑膜淋巴管受损,沿横窦的B细胞群体在区域上的差异。我们独特发现的其他潜在驱动因素包括性别和微生物群的差异,这两者也可能影响脑膜中B细胞的数量和频率。总的来说,这表明老年小鼠中的B细胞群体组成可能与年轻小鼠有显著不同;然而,未来的研究需要更详细地正式评估这一点。
除了与抗体相关的基因上调之外,我们还观察到批量RNA测序数据集中I型干扰素(IFN)相关基因的表达增加(图6h)。在各种神经系统疾病中,已显示I型IFNs在脑实质中上调,在促进疾病发病机制方面通常被认为起有害作用(Karve等,2016年;Barrett等,2020年;Baruch等,2014年;Abdullah等,2018年;Zhang等,2017年)。我们的数据表明,在老年小鼠的脑膜隔室中也看到了这种I型IFN特征。我们看到包括Ifit1、Ifit2、Irf7、Ifi213和Mx1在内的I型IFN相关基因显著增加(图6h)。这些发现表明,衰老促进了脑膜转录组的深刻变化。此外,抗体基因和I型IFN相关基因的上调表明老年脑膜中整体免疫激活状态的提高。
![图片[10]-文献阅读:脑膜对创伤性脑损伤和衰老的转录反应-吃了吃了](https://cdn.ineuro.net/cloudreve%2F2024%2F01%2F18%2FktxO8YP2_6.png)
2.7 老年小鼠的伤害导致延长的炎症反应
为了评估与年轻小鼠相比,老年小鼠对TBI的独特转录反应,我们分析了仅存在于年轻TBI与老年TBI比较中、而不与年轻Sham与老年Sham比较共享的转录反应,在整体RNA-seq数据集中。这包括917个下调基因和639个上调基因,这些基因是年轻TBI与老年TBI比较中独有的(图5d)。尽管衰老和TBI每个单独的条件都导致一些重叠的基因表达变化,但结合TBI与老龄化的双重打击被发现引发比单独任何条件更大的基因表达变化。
使用GO分子功能术语,我们发现在年轻TBI与老年TBI比较中独特的被抑制基因中,许多基因涉及结合过程,包括蛋白质结合和细胞骨架结合(图7a)。当我们更仔细地观察老年TBI与年轻TBI比较中特有的顶级被抑制基因时,我们观察到许多这些基因编码胶原酶(如Col4a1、Col4a2和Col5a2)和其他参与调节细胞连接的分子(如Jup)(图7b)。使用qPCR,我们验证了一些对胶原酶产生重要的基因确实在TBI后1.5个月在老年小鼠的硬膜脑膜中下调(图7c)。这些途径可能有助于脑膜的伤口愈合反应,并在年轻小鼠的TBI反应中上调(图3),然而在衰老中的脑损伤后被下调。
此外,我们研究了与年轻TBI小鼠相比,独特激活的老年TBI小鼠的基因。我们发现与免疫激活相关的基因在老年TBI小鼠中与其年轻TBI对应物相比显著上调(图7d)。最富集的GO生物过程包括“防御反应”和“免疫系统过程”(图7d)。一些对这些免疫相关术语的上调有贡献的基因包括与免疫球蛋白产生相关的基因(Ighg2c)、T细胞和B细胞信号传导(Cd24a、Zap70、Cxcr6)以及细胞死亡(Casp12、C2)(图7e)。总之,这些发现突显了TBI后老年脑膜组织中看到的一些独特变化。具体来说,我们发现老年小鼠的轻度TBI导致免疫基因的长期激活和细胞外基质重塑以及维持细胞连接所涉及的基因表达的减少。此外,我们报道,尽管年轻小鼠的脑膜转录组在轻微头部受伤后的1.5个月几乎完全恢复到基线休息水平,与之相反,老年脑膜继续展示与头部受伤相关的显著和长期的转录变化。
![图片[11]-文献阅读:脑膜对创伤性脑损伤和衰老的转录反应-吃了吃了](https://cdn.ineuro.net/cloudreve%2F2024%2F01%2F18%2Ffdu1AaoT_7.png)
2.8 与免疫系统相关的转录变化将年轻小鼠TBI驱动的基因表达模式与老龄化中看到的慢性变化联系起来
最后,我们想要研究老年小鼠是否持续存在TBI后的基因表达变化,通过识别伤后一周的年轻小鼠与伤后1.5个月的老年小鼠之间的共同基因表达模式。为此,我们查看了scRNA-seq数据集(TBI后一周)和批量RNA-seq数据集(TBI后1.5个月),以确定是否存在共享的差异表达基因。首先,我们将scRNA-seq数据集中的T细胞、B细胞、成纤维细胞和巨噬细胞的差异表达基因与年轻Sham与老年Sham比较的差异表达基因进行了比较,以确定这些基因中是否有一些与单纯老龄化共享(图8a)。虽然有139个共享的差异调节基因,但每个数据集中的大多数差异表达基因并未共享(图8a)。当我们更仔细地观察共享的下调基因时,我们发现许多基因对伤口愈合和结缔组织维护很重要(图8c)。这些数据表明,一些对伤口愈合重要的下调基因在TBI后的亚急性时间点仍然在老年脑膜中持续下调,进一步支持老年脑膜在基线上可能对伤害的反应能力较差的观点。在亚急性时间点和老龄化过程中共享的上调基因中,一些基因有助于异常免疫细胞生理状态、先天免疫反应和免疫细胞激活,再次支持老年脑膜采用慢性、基线上的免疫系统激活的观点(图8c)。另一方面,尽管年轻脑膜在TBI后一周最初上调了一些对炎症反应重要的基因,但基因表达水平最终会恢复到基线。
更仔细地观察Young TBI与Aged TBI批量RNA测序比较和scRNA-seq数据集中的T细胞、B细胞、成纤维细胞和巨噬细胞之间共享的差异调节基因,我们发现共有119个基因(图8b)。与单纯老龄化类似,许多共同上调的基因与异常免疫细胞激活有关,反映了老龄化中TBI后发生的慢性激活免疫反应(图8d)。在共享的下调基因中,许多基因有助于细胞粘附和对内质网应激的反应(图8d)。总的来说,尽管在批量RNA和scRNA测序数据集中的大多数差异表达基因并未共享,但共同基因反映了异常免疫细胞激活和愈合反应缺陷的模式,这通过对胞外基质修复和细胞粘附重要的基因的下调得到体现。虽然老年小鼠在伤后1.5个月仍表现出这种特征,但年轻小鼠最初表达这些共享基因,然后在伤后1.5个月恢复到基线水平。







暂无评论内容